
【题目】甲醇(CH3OH)是一种优质燃料,(1)已知一定条件下88gCO2和足量氢气完全反应可生成气态甲醇(CH3OH)和水蒸汽并放出98kJ的热量。 请回答:
(1)该反应的热化学方程式: __________________________________________。
(2)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图。请回答:
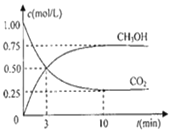
①从反应开始到平衡,氢气的反应速率:υ(H2)=______。
②下列措施中能使υ(CO2)增大的是______。
A 加入催化剂 B 充入He(g),使体系压强增大
C 将H2O(g)从体系中分离 D 升高温度
③能够说明该反应已达到平衡的是______。
A 恒温、恒容时,容器内的压强不再变化 B 恒温、恒容时,容器内混合气体的密度不再变化 C 一定条件下,CO2、H2和CH3OH的浓度不再变化 D 一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH E 有2个C=O键断裂的同时,有3个H-H键断裂
(3)甲醇—空气碱性燃料电池在生活中有着广泛的应用,写出该电池正极的电极反应式_____________。
【答案】CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=﹣49.0kJ/mol 0.225 molL-1min-1 AD AC O2+2H2O+4e-=4OH-
【解析】
(1)根据n=m/M,计算88gCO2和氢气化合生成甲醇和水放出的热量,结合热化学方程式书写方法标注物质聚集状态和反应焓变写出;
(2)①υ=△c/△t和同一化学反应中不同物质表示的化学反应速率之比等于计量数之比,求反应速率;
②根据升高温度,增大浓度,增大压强,加入催化剂等可以加快反应速率判断如何增加CO2的反应速率;
③可逆反应达到平衡状态时,同种物质的正逆反应速率相等,用不同的物质表示正逆反应速率时等于计量数之比;平衡时,各物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变。
(3)甲醇燃料电池中,正极O2发生得电子的还原反应。
(1)88gCO2的物质的量为2mol,2molCO2完全反应可以放出98kJ的热量。根据原子守恒,配平化学方程式,CO2(g)+3H2(g)=CH3OH(g)+H2O(g),化学方程式中为1molCO2参加反应完全反应时放出的热量为49kJ。热化学方程式需要标准物质的状态,以及焓变,热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=﹣49.0kJ/mol;
(2)①根据图示,从反应到平衡时,CO2的浓度从1mol·L-1降低到0.25mol·L-1,共用时10min。根据υ(CO2)=![]() ;同一化学反应中,不同物质表示的化学反应速率之比等于化学计量数之比,则有υ(CO2):υ(H2)=1:3,可得υ(H2)=0.225mol·L-1·min-1。
;同一化学反应中,不同物质表示的化学反应速率之比等于化学计量数之比,则有υ(CO2):υ(H2)=1:3,可得υ(H2)=0.225mol·L-1·min-1。
②A.加入催化剂,可以降低反应活化能,增大化学反应速率,A符合题意;
B.充入He,虽然体系的压强增大,但是CO2的浓度不变,化学反应速率不变;B项不符合题意;
C.将H2O从体系中分离的瞬间,CO2的浓度不变,CO2的速率不变;C项不符合题意;D.升高温度,化学反应速率增大,D项符合题意;
答案为AD;
③A.恒温恒容时,压强之比等于物质的量之比,反应前后物质的量发生改变,则压强发生改变,当压强不变的时候,说明各物质的物质的量不变,反应达到了平衡;A项符合题意;
B.![]() ,各反应物均为气体,m总不变,恒容容器,V不变,说明密度一直不变,密度不变不能说明反应达到了平衡;B项不符合题意;
,各反应物均为气体,m总不变,恒容容器,V不变,说明密度一直不变,密度不变不能说明反应达到了平衡;B项不符合题意;
C.达到平衡状态时,各物质消耗的速率和生成的速率相等,所以各物质的浓度不再发生变化,C项符合题意;
D.消耗H2为正反应速率,生成甲醇也是正反应速率,无法得知正逆反应是否相等,无法得知是否平衡;D项不符合题意;
E.C=O键断开,表示的为正反应速率,H-H键断开也表示正反应速率,无法得知正逆反应是否相等,无法得知是否平衡;E项不符合题意;
答案为AC;
(3)甲醇-空气燃料电池,正极的反应物为O2。电解质溶液为碱性,氧气得到电子和水反生生成OH-,电极方程式为O2+2H2O+4e-=4OH-。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
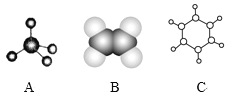
【题目】下图中A、B、C分别是三种有机物的结构模型:
请回答下列问题:
(1)A、B两种模型分别是有机物____模型和___模型。
(2)A及其同系物的分子式符合通式____(用n表示)。当n=____时,烷烃开始出现同分异构体。
(3)A、B、C三种有机物中,所有原子均共面的是___(填名称)。结构简式为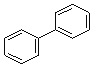 的有机物中,处于同一平面内的碳原子数至少为____。
的有机物中,处于同一平面内的碳原子数至少为____。
(4)有机物C不具有的结构或性质是_____(填字母序号)。
a.是碳碳双键和碳碳单键交替的结构 b.有毒、不溶于水、密度比水小
c.不能使酸性KMnO4溶液和溴水褪色 d.一定条件下能与氢气或氧气反应
(5)等质量的三种有机物完全燃烧生成H2O和CO2,消耗氧气的体积(相同状况下)最大的是__(填A、B、C)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尼龙66广泛用于制造机械、汽车、化学与电气装置的零件,亦可制成薄膜用作包装材料,其合成路线如图所示(中间产物E给出了两条合成路线)。
已知:R—Cl![]() R—CN
R—CN![]() R—CH2NH2
R—CH2NH2
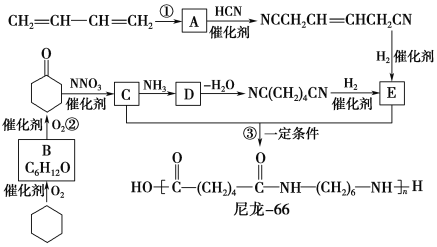
完成下列填空:
(1)写出反应类型:反应②________;反应③________。
(2)写出化合物D的结构简式:_____________________________________。
(3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:________________________。
(4)写出反应①的化学方程式:________________________________________________________________。
(5)下列化合物中能与E发生化学反应的是________。
a.NaOH B.Na2CO3
c.NaCl D.HCl
(6)用化学方程式表示化合物B的另一种制备方法(原料任选):_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(C6H10O5)n![]() C6H12O6
C6H12O6![]() CH2OH(CHOH)4COOH。 下列说法正确的是( )
CH2OH(CHOH)4COOH。 下列说法正确的是( )
A. (C6H10O5)n和C6H12O6互为同系物
B. 反应②属于加成反应
C. 向①反应后的溶液中直接滴加银氨溶液并加热,可验证C6H12O6的生成
D. 1 mol CH2OH(CHOH)4COOH最多消耗6 molNa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是重要的化工原料,其分子结构具有对称美,下列说法正确的是( )
A.苯分子中只含有碳碳单键B.苯能与溴水发生取代反应
C.苯分子中所有原子位于同一平面D.苯能使KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ写出下列化学反应方程式 :①苯的硝化反应: ________ ②淀粉水解的化学方程式: __________
Ⅱ写出下列物质的电子式 :CaCl2________;HClO________;Na2O2________;CO2________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色溶液中大量共存的一组离子是
A. Cu2+、SO42—、OH—、K+ B. Fe3+、NO3—、Cl—、H+
C. K+、CO32—、Cl—、H+ D. H+、Na+、Cl—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示进行实验,下列说法不正确的是
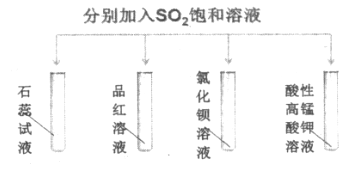
A. 石蕊试液变红说明SO2的水溶液显酸性
B. 品红溶液、酸性高锰酸钾溶液褪色原因不相同
C. BaCl2溶液中开始没有明显现象,一段时间后缓慢出现浑浊,该浑浊为BaSO3
D. 该实验说明SO2的性质具有多样性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com