

 )外,最可能生成的副产物(与G互为同分异构体)的结构简式为
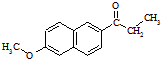
)外,最可能生成的副产物(与G互为同分异构体)的结构简式为 )的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式:
)的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式:| SOCl2 |
 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).| HBr |
| NaOH |
| △ |
 )外,最可能生成的副产物(与G互为同分异构体),应为邻位取代产物;
)外,最可能生成的副产物(与G互为同分异构体),应为邻位取代产物; )的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰,则X中含萘环,含-COOC-及-Cl,水解产物中只有5种位置的H;
)的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰,则X中含萘环,含-COOC-及-Cl,水解产物中只有5种位置的H; ,先发生CH3COOH
,先发生CH3COOH| SOCl2 |
 )外,最可能生成的副产物(与G互为同分异构体),应为邻位取代产物,其结构简式为
)外,最可能生成的副产物(与G互为同分异构体),应为邻位取代产物,其结构简式为 ,故答案为:
,故答案为: ;
; )的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰,则X中含萘环,含-COOC-及-Cl,水解产物中只有5种位置的H,X可能的结构简式为
)的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰,则X中含萘环,含-COOC-及-Cl,水解产物中只有5种位置的H,X可能的结构简式为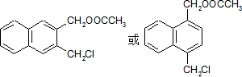 ,
, ;
; ,先发生CH3COOH
,先发生CH3COOH| SOCl2 |
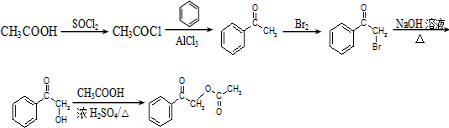 ,
, .
.


科目:高中化学 来源: 题型:
 某温度下,体积和pH都相同的盐酸和AlCl3溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
某温度下,体积和pH都相同的盐酸和AlCl3溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )| A、Al(OH)3的电离方程式为:Al(OH)3═Al3++3OH- |
| B、a点溶液中有:c(H+)+c(Al3+)═c(OH-)+3c(Cl-) |
| C、曲线X表示盐酸稀释过程的PH变化 |
| D、b、c两溶液c(OH-)及c(Cl-)均相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最外层电子数为2的原子一定比最外层电子数为3的原子容易失去电子 |
| B、元素的非金属性越强最高价氧化物对应的水化物酸性越强 |
| C、ⅠA族元素都是碱金属元素 |
| D、元素周期表中金属元素与非金属元素的分界线附近的一些元素能用于制农药 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,用0.1000mol?L-1 NaOH溶液分别滴定20.00mL 0.1000mol?L-1 HA和HB溶液,得到2条滴定曲线,如下图所示(图1表示HA,图2表示HB),下列说洼正确的是( )
常温下,用0.1000mol?L-1 NaOH溶液分别滴定20.00mL 0.1000mol?L-1 HA和HB溶液,得到2条滴定曲线,如下图所示(图1表示HA,图2表示HB),下列说洼正确的是( )| A、HA是弱酸,HB是强酸 |
| B、达到E点时,对应混合溶液中c(Na+)=c(B-)+c(HB) |
| C、达到B、D点时,两溶液pH均为7,反应消耗的n(HA)=n(HB) |
| D、当达到E点后,继续滴加NaOH溶液,对应混合溶液中各离子浓度由大到小的顺序均为c(Na+)>c(B-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com