
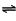 2 NH3(气),平衡时混合气共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
2 NH3(气),平衡时混合气共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
在以上条件下,向体积不变的密闭容器中通入1 mol SO2和0.5 mol O2,反应达到平衡时放出热量为Q1 kJ;在同样的条件下向同样的密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量为Q2 kJ。则下列关系正确的是( )
A.2Q1=Q2 B.2Q1>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,向体积不变的密闭容器中充入1.0molN2和3.0molH2,反应达到平衡时,测得NH3的物质的量为0.6mol。若该容器中开始时N2的物质的量为2.0mol,H2为6.0mol,则平衡时NH3的物质的量为( )
A.n(NH3)=1.2mol
B.n(NH3)<1.2mol
C.n(NH3)>1.2mol
D.无法确定
查看答案和解析>>
科目:高中化学 来源:2011-2012学年陕西省咸阳市渭城中学高二上学期期中考试化学试卷 题型:填空题
(每空2分共8分)
向体积不变的密闭容器中充入2 mol N2和6 mol H2,一定条件下发生反应:
N2(g)+ 3 H2(g) 2 NH3(g),平衡时混合气体共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
2 NH3(g),平衡时混合气体共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
①.若a=0,b=0,则c=
②.若a=0.7,b=2.1,则:
Ⅰ.c= .
Ⅱ.这时反应向 进行.
Ⅲ.若要维持反应开始向该反应方向进行,c的范围是
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省等五校高三第二次联考理综化学试卷(解析版) 题型:填空题
(1)已知:O2 (g)= O2+ (g)+e- △H1= +1175.7 kJ·mol-1
PtF6(g)+ e-= PtF6-(g)???? △H2= - 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- (g)?? △H3=+482.2 kJ·mol-1
则反应:O2(g)+ PtF6 (g) = O2+PtF6(s)的△H=_____ kJ·mol-1。
如图为合成氨反应在使用相同的催化剂,不同温度和压强条件下进行反 应,初始时N2和H2的体积比为1:3时的平衡混合物中氨的体积分数:

① 在一定的温度下,向体积不变的密闭容器中充入氮气和氢气发生上述反应,下列能说明反应达到平衡状态的是??????? 。
a.体系的压强保持不变?? ???? b.混合气体的密度保持不变
c.N2和H2的体积比为1:3????? d.混合气体的平均摩尔质量不变
②分别用vA(NH3)和vB(NH3)表示从反应开始到平衡状态A、B时的反应速率,则vA(NH3)??? vB(NH3)(填“>”、“<”或“=”),该反应的的平衡常数kA ??? kB(填“>”、“<”或“=”),在250 ℃、1.0×104kPa下达到平衡,H2的转化率为????? %(计算结果保留小数点后一位);
(3)25℃时,将a mol NH4NO3溶于水,溶液呈酸性,原因???????????????????????? ?????????? (用离子方程式表示)。向该溶液中加入bL氨水后溶液呈中性,则所加氨水的浓度为?????????? mol/L(用含a、b的代数式表示,NH3·H2O的电离平衡常数为Kb=2×10-5)
(4)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。电镀一段时间后,装置Ⅰ中溶液的pH ???? (填“变大”、“变小”或“不变”),a极电极反应方程式为????????????????? ;若电镀结束后,发现装置Ⅱ中阴极质量变化了25.6g(溶液中硫酸铜有剩余),则装置Ⅰ中理论上消耗甲烷????? L(标准状况下)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com