


16 8 |
17 8 |
18 8 |
1 1 |
2 1 |
3 1 |
2 1 |
18 8 |
| 15.6g |
| 0.2mol |
 ,
, ;
;2 1 |
18 8 |
| m |
| M |
| 22g |
| 22g/mol |


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| Cu2O |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

查看答案和解析>>
科目:高中化学 来源: 题型:
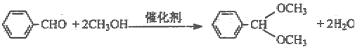
| 铌酸用量/mol | 0.01 | 0.02 | 0.03 | 0.05 | 0.1 | 0.15 | 0.2 | 0.6 |
| 产率% | 87.3 | 88.2 | 90.3 | 94.2 | 92.9 | 93.1 | 91.8 | 92.3 |
| 转化率% | 89.7 | 92.1 | 93.9 | 98.9 | 94.9 | 95.7 | 93.9 | 94.3 |
| 序号 | 醛 | 醇 | 转化率% | 产率% |
| 1 | 邻羟基苯甲醛 | 甲醇 | 94.3 | 89.6 |
| 2 | 对羟基苯甲醛 | 甲醇 | 93.6 | 88.7 |
| 3 | 邻氯苯甲醛 | 甲醇 | 93.1 | 87.3 |
| 4 | 间硝基苯甲醛 | 甲醇 | 54.2 | 34.1 |
| 5 | 邻硝基苯甲醛 | 甲醇 | 89.9 | 79.5 |
| 6 | 对硝基苯甲醛 | 甲醇 | 65.7 | 41.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
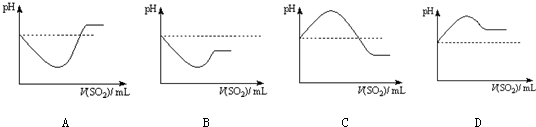
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com