
【题目】亚氯酸钠(NaClO2)是一种应用广泛的高效氧化型漂白剂。以下是某小组模拟工业制法利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置:

已知:(1)硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
(2)ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
(3)饱和NaClO2溶液在温度低于38℃时析出晶体NaC1O23H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(1)实验前用浓硫酸与50%甲醇溶液配制混合溶液的操作是:___________。
(2)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是___________。
(3)装置A中,若氧化产物为CO2,则氧化剂与还原剂的物质的量之比为___________。
(4)装置B中生成NaClO2的化学方程式是____。
(5)从反应后的B溶液中制得NaClO2晶体的操作步骤是:a.___;b._____;c.用38~60℃的热水洗涤;d.在低于60oC的真空中蒸发,干燥。
(6)装置C中C1O2与NaOH溶液反应生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中C1O2与NaOH溶液反应的化学方程式为______。
(7)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,判断达到滴定终点时的现象为_____。重复滴定3次,测得Na2S2O3标准液平均用量为18.00mL,则该样品中NaClO2的质量分数为____________。
【答案】将一定量的浓硫酸沿容器壁慢慢注入50%的甲醇溶液中,并不断搅拌 降低ClO2的浓度(或减小ClO2的体积分数),防止爆炸 6:1 2ClO2+H2O2+2NaOH![]() 2NaClO2+O2+2H2O 控制在38~60℃之间蒸发浓缩 控制温度在38~60℃之间趁热过滤 2ClO2+2NaOH=NaClO2+NaClO3+H2O 溶液由蓝色变无色,且30秒内不恢复蓝色 81.45%
2NaClO2+O2+2H2O 控制在38~60℃之间蒸发浓缩 控制温度在38~60℃之间趁热过滤 2ClO2+2NaOH=NaClO2+NaClO3+H2O 溶液由蓝色变无色,且30秒内不恢复蓝色 81.45%
【解析】
为避免酸液沸腾而飞溅,将浓硫酸沿容器壁慢慢注入50%的甲醇溶液中,并不断搅拌得到浓硫酸和甲醇的混合溶液。该混合液和NaClO3在三颈烧瓶中反应产生ClO2,ClO2和H2O2、NaOH在B中反应产生NaClO2,多余的ClO2用C中NaOH溶液吸收。
(1)浓硫酸密度大且溶于水放出大量的热,所以,将浓硫酸与50%甲醇溶液配制混合溶液的操作是:将一定量的浓硫酸沿容器壁慢慢注入50%的甲醇溶液中,并不断搅拌,故答案为:将一定量的浓硫酸沿容器壁慢慢注入50%的甲醇溶液中,并不断搅拌;
(2)气体中ClO2浓度较高时易发生爆炸,实验过程中需要持续通入CO2的目的,一是搅拌作用,二是降低ClO2的浓度(或减小ClO2的体积分数),防止爆炸,故答案为:降低ClO2的浓度(或减小ClO2的体积分数),防止爆炸;
(3)装置A中,CH3OH作还原剂,氧化产物为CO2,C元素化合价升高6,NaClO3是氧化剂,还原产物为ClO2,Cl元素化合价降低1,根据电子得失守恒可知,CH3OH与NaClO3的物质的量之比为1:6,即氧化剂与还原剂的物质的量之比为6:1,故答案为:6:1;
(4)ClO2和H2O2、NaOH在B中反应产生NaClO2,ClO2作氧化剂,还原产物为NaClO2,H2O2作还原剂,氧化产物是O2,结合电子得失守恒、原子守恒可得装置B中方程式为:2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O,故答案为:2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O;
(5)饱和NaClO2溶液在温度低于38℃时析出晶体NaC1O23H2O,高于60℃时分解,在38~60℃之间析出NaClO2,故要控制温度在38~60℃之间蒸发浓缩,并且趁热过滤除去母液,得到的晶体也要用38~60℃的热水洗涤,在低于60oC的真空中蒸发,干燥,故答案为:控制在38~60℃之间蒸发浓缩;控制温度在38~60℃之间趁热过滤;
(6)C1O2与NaOH溶液反应生成等物质的量的两种钠盐,其中一种为NaClO2,Cl元素的化合价降低1,则另一种产物必为NaClO3,结合原子守恒可知,另一种产物为H2O,即C1O2与NaOH溶液反应的化学方程式为2ClO2+2NaOH=NaClO2+NaClO3+H2O,故答案为:2ClO2+2NaOH=NaClO2+NaClO3+H2O;
(7)NaClO2将I-氧化成I2,加入淀粉碘化钾,溶液为蓝色,用Na2S2O3滴定溶液由蓝色变为无色,且30s内不恢复为蓝色,说明I2消耗完,此时为滴定终点。滴定消耗Na2S2O3物质的量=0.2000mol/L×18mL×10-3=3.6×10-3mol,根据得失电子守恒有以下关系:NaClO2~Cl-~4e-~4I-~2I2~4Na2S2O3,故3.6×10-3mol Na2S2O3对应NaClO2的物质的量=![]() =9×10-4mol,则1.000g样品中NaClO2的物质的量n=9×10-4×10mol=9×10-3mol,质量m=9×10-3mol×90.5g/mol=0.8145g,则该样品中NaClO2的质量分数=
=9×10-4mol,则1.000g样品中NaClO2的物质的量n=9×10-4×10mol=9×10-3mol,质量m=9×10-3mol×90.5g/mol=0.8145g,则该样品中NaClO2的质量分数=![]() =81.45%,故答案为:溶液由蓝色变无色,且30秒内不恢复蓝色;81.45%。
=81.45%,故答案为:溶液由蓝色变无色,且30秒内不恢复蓝色;81.45%。


科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容容器中,用CO2和H2合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。将1molCO2和3molH2在反应器中反应8小时,CH3OH的产率与温度的关系如图所示。下列说法正确的是( )
CH3OH(g)+H2O(g)。将1molCO2和3molH2在反应器中反应8小时,CH3OH的产率与温度的关系如图所示。下列说法正确的是( )
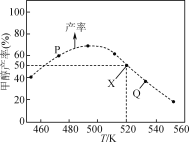
A.反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH>0
CH3OH(g)+H2O(g)的ΔH>0
B.图中P点所示条件下,延长反应时间能提高CH3OH的产率
C.图中Q点所示条件下,增加CO2的浓度可提高H2的转化率
D.520K时,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=
CH3OH(g)+H2O(g)的平衡常数K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备氰氨基化钙的化学方程式为CaCO3+2HCN![]() CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
A. 氢元素被氧化, 碳元素被还原
B. HCN被氧化, CaCO3被还原
C. HCN是氧化剂, CaCO3是还原剂
D. CaCN2是氧化产物, H2为还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,用0.1000mol/L的NaOH溶液滴定40.00mL0.1mol/L的某二元弱酸H2R溶液,所得滴定曲线如图所示(设所得溶液体积等于两种溶液体积之和)。下列说法正确的是
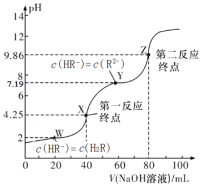
A.若只滴定到第一反应终点,可用酚酞做指示剂
B.图中Y点对应的溶液中:c(Na+)+c(H+)=2c(HR-)+c(OH-)
C.图中Z点对应的溶液中c(Na+)约为0.067mol/L,R2-的水解率大于1%
D.若pK=-lgK,2HR-![]() R2-+H2R达平衡时pK=5.19
R2-+H2R达平衡时pK=5.19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与100mL0.5mol/LNaCl溶液所含的Cl-物质的量相同的溶液是
A.50 mL1mol/LNaCl溶液B.200mL0.25mol/L AlCl3溶液
C.100 mL0.5mol/LMgCl2溶液D.25mL0.5mol/LHCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、F、Ga、As是新一代太阳能电池、半导体材料中含有的主要元素。回答下列问题:
(1)基态Ga原子的核外电子排布式是__________,基态Ga原子核外电子占据最高能级的电子云轮廓图为________。
(2)在第四周期中,与基态As原子核外未成对电子数目相同的元素为__________。
(3)NF3的立体构型为_______。N2F2分子中各原子都满足8电子结构,分子中σ键和π键的个数比为______,氮原子的杂化轨道类型为__________。
(4)B、Al、Ga单质的熔点依次为2300°C,660°C,29.8°C,解释熔点产生差异的原因______。
(5)由B、N、F组成的某离子化合物中,B、N、F的原子个数比为1:1:8,其阴、阳离子互为等电子体,该化合物中的阳离子、阴离子符号分别为__________。
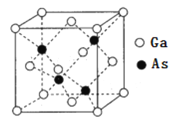
(6)GaAs晶体结构如图所示。
①图中As原子的坐标参数为![]() ,_______。
,_______。
②已知晶胞中相邻且最近的Ga、As原子的核间距为acm,NA为阿伏加德罗常数的值,晶体的密度为___________g/cm3(填写表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
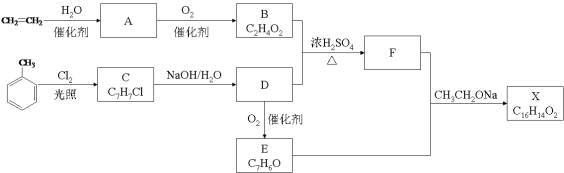
已知:RX![]() ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’![]() RCH=CHCOOR’
RCH=CHCOOR’
请回答:
(1)E中官能团的名称是 。
(2)B+D→F的化学方程式 。
(3)X的结构简式 。
(4)对于化合物X,下列说法正确的是 。
A.能发生水解反应 B.不与浓硝酸发生取代反应
C.能使Br2/CCl4溶液褪色 D.能发生银镜反应
(5)下列化合物中属于F的同分异构体的是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下CH4、H2S、NH3均为气体,分别有①11.2L H2S②16g CH4③1.204×1024个NH3分子,下列物理量大小比较正确的是( )
A. 体积:②>③>①
B. 密度:③>②>①
C. 质量:③>②>①
D. 原子总数:③>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com