
| m |
| M |
| V |
| 22.4L/mol |
| n |
| V |
| 1000ρω |
| M |
| 4.5g |
| 18g/mol |
| x |
| 98g/mol |
| 2 |
| 3 |
| 4 |
| 3 |
| 1 |
| 2 |
| 1 |
| 2 |
| 4 |
| 3 |
| 2 |
| 15 |
| 4 |
| 3 |
| 2 |
| 15 |
| 5.6L |
| 22.4L/mol |
| 0.25mol |
| 0.5L |
| 1000×1.84×98% |
| 98 |
| 18.4mol/L×0.1L |
| 0.2L |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
| A、SO2、SiO2、CO均为酸性氧化物 |
| B、稀豆浆、雾、氯化钠溶液均可形成胶体 |
| C、烧碱、冰醋酸、四氯化碳均为电解质 |
| D、盐酸、溴水、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
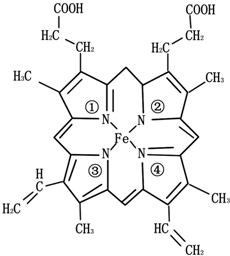 金属及其化合物在生产、生活中有广泛应用.
金属及其化合物在生产、生活中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:
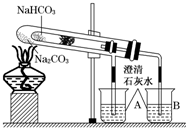 “套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验.因其有许多优点,近年来被广泛开发并应用于化学实验中.下面这个实验为“套管实验”,实验装置中,小试管中部有沾上无水硫酸铜粉末的脱脂棉.请观察实验装置,分析实验原理,并回答下列问题:
“套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验.因其有许多优点,近年来被广泛开发并应用于化学实验中.下面这个实验为“套管实验”,实验装置中,小试管中部有沾上无水硫酸铜粉末的脱脂棉.请观察实验装置,分析实验原理,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol | B、3mol |
| C、4mol | D、6mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com