

分析 (1)根据反应热=反应物的总键能-生成物的总键能计算;根据盖斯定律计算Q;
(2)①根据压强对化学平衡的影响分析;化学平衡常数与温度相关,温度不变,化学平衡常数K不变;
②由图要求压强越大,X的值越大,结合影响化学平衡的因素分析;
(3)①a物质的浓度减少,说明a为反应物,根据参与反应物质的反应比例与化学计量数之比可知a为氨气;反应速率由$\frac{△c}{△t}$计算;
②根据化学平衡常数为生成物浓度幂之积与反应物浓度幂之积之比计算.
解答 解:(1)设NO中的化学键键能为x,反应①4NH3(g)+5O2 (g)?4NO(g)+6H2O(g)△H=12×391+5×497-4x-12×463=-905,解得x=631.5;
已知:①4NH3(g)+5O2 (g)?4NO(g)+6H2O(g)△H=-905KJ/mol
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol
根据盖斯定律(①+2×②-3×③)÷2可得④N2 (g)+O2 (g)═2NO (g)△H=+180.5KJ/mol;
故答案为:631.5;+180.5;
(2)①反应4NH3(g)+5O2 (g)?4NO(g)+6H2O是个气体体积增大的反应,增大压强,化学平衡逆向移动,NH3的百分含量增大,由图可知p2的氨气百分含量大故p2>p1;b、c两点对应的温度不变,故平衡常数K(b)=K(c);
故答案为:>;=;
②对该反应,压强增大,反应逆向移动,a.混合气体的质量不变,逆向移动气体总物质的量变小,根据$\overline{M}=\frac{m}{n}$平均摩尔质量增大,正确;b.反应逆向移动,NO的产率减小,错误;c.具体反应4NH3(g)+5O2 (g)?4NO(g)+6H2O的△H不变,错误;
故答案为:a;
(3)①a物质的浓度减少,说明a为反应物,由图可知,前10min,△c(NO):△c(a)=0.6:0.6=1:1,
则a为氨气;前3min氨生成NO0.4mol/L,则生成的H2O为0.6mol/L,则前3min内H2O表示的平均反应速率为v(H2O)=$\frac{0.6mol/L}{3min}$=0.20mol/(L•min);
故答案为:NH3; 0.20mol/(L•min);
②由图可知反应在10min平衡,向2L某恒容器密闭容器中充入1.6molNH3,3.3molO2,
4NH3(g)+5O2 (g)?4NO(g)+6H2O
c始:0.8 1.65 0 0
c转:0.6 0.75 0.6 0.9
c平:0.2 0.9 0.6 0.9
则K=$\frac{0.{9}^{6}×0.{6}^{4}}{0.{2}^{4}×0.{9}^{5}}$=72.9;
故答案为:72.9.
点评 本题考查了盖斯定律、反应热与键能的关系、影响化学平衡的因素以及有关化学平衡的计算,注重对学生基础的考查,题目难度不大,注意反应热的符号单位.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH[H2O] | B. | CuCl2[CuSO4] | C. | NaCl[NaCl] | D. | CuSO4[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡O | Cl-Cl | Cl-N | N═O |
| 键能/kJ•mol-1 | 630 | 243 | a | 607 |
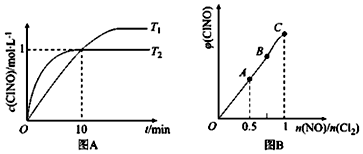
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用丁达尔效应分离Fe(OH)3胶体和FeCl3溶液 | |
| B. | Fe(OH)3胶体的胶粒带正电荷,通电时胶粒向直流电源的负极移动,这种现象称为电泳 | |
| C. | 向沸腾蒸馏水逐滴加饱和FeCl3溶液,至液体呈透明红褐色时即得到Fe(OH)3胶体 | |
| D. | 向沸腾的NaOH稀溶液中边滴加FeCl3饱和溶液,边用玻璃棒搅动,然后继续煮沸,制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
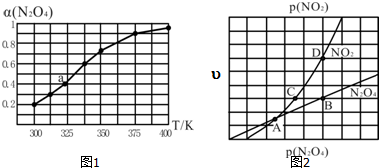
| 化学键 | N-H | N-N | N≡N | O-H |
| E/(kJ•mol-1) | 390 | 190 | 946 | 460 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
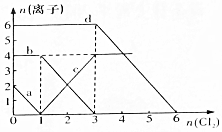 已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:
已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com