
| A. | NaOH[H2O] | B. | CuCl2[CuSO4] | C. | NaCl[NaCl] | D. | CuSO4[Cu(OH)2] |
分析 电解池中,要想使电解质溶液复原,遵循的原则是:电解后从溶液中减少的物质是什么就利用元素守恒来加什么,据此进行解答.
解答 解:A.电解NaOH溶液时,阳极产生氧气,阴极产生氯气,所以应加水让电解质溶液复原,故A正确;
B.电解CuCl2溶液时,阳极氯离子放电生成氯气,阴极铜离子得到电子生成铜单质,所以应加CuCl2让电解质溶液复原,故B错误;
C.电解NaCl溶液时,阳极氯离子放电生成氯气,阴极氢离子得到电子生成氢气,所以应加HCl让电解质溶液复原,故C错误;
D.电解硫酸铜时,阳极产生氧气,阴极产生金属铜,所以应加CuO让电解质溶液复原,加入氢氧化铜会多加入水,故D错误;
故选A.
点评 本题考查了电解池原理,题目难度不大,明确电解原理为解答关键,分析两个电极上产生的物质,本着“出什么加什么”的思想来让电解质复原,试题培养了学生的分析能力及灵活应用能力.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
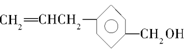 ,下列关于有机物A的说法错误的是( )
,下列关于有机物A的说法错误的是( )| A. | 有机物A可以与氯气反应 | |
| B. | 有机物A与 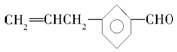 互为同分异构体 互为同分异构体 | |
| C. | 有机物A可与CH3COOH发生酯化反应 | |
| D. | 有机物A可以使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
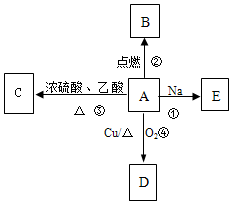 A是易溶于水的有机物C2H5OH,能发生如图所示的多种反应(部分产物已略),D的相对分子质量为44,分子式为C2H4O.请回答下列问题:
A是易溶于水的有机物C2H5OH,能发生如图所示的多种反应(部分产物已略),D的相对分子质量为44,分子式为C2H4O.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
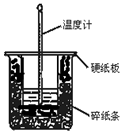 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | △H/(kJ?mol-1) | 化学式 | △H/(kJ?mol-1) |
| CO(g) | -283.0 | CH4(g) | -890.3 |
| H2(g) | -285.8 | CH3OH(l) | -726.5 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com