
【题目】从海带中提取碘单质,工艺流程如下。下列关于海带制碘的说法错误的是
干海带![]() 海带灰
海带灰![]() 悬浊液
悬浊液![]() 滤液
滤液![]() 碘水
碘水![]() I2的CCl4溶液
I2的CCl4溶液
A. 实验室灼烧干海带在坩埚中进行
B. 沸水浸泡的目的是使I—充分浸出
C. 由滤液获得碘水,发生的离子反应为2I—+H2O2═I2+2OH—
D. 碘水中加入CCl4得到I2的CCl4溶液,该操作为“萃取”
【答案】C
【解析】
干海带灼烧得到海带灰,海带灰溶于沸水过滤得到含有碘离子的滤液,加入酸化的过氧化氢溶液氧化碘离子生成碘单质,加入四氯化碳萃取分液得到碘的四氯化碳溶液,据此分析解答。
A.固体灼烧应在坩埚中进行,蒸发溶液在蒸发皿中加热,故A正确;
B.沸水浸泡海带灰的目的是加快I-的溶解,并使之溶解更充分,故B正确;
C.碘离子被过氧化氢氧化为碘单质,发生氧化还原反应,用过氧化氢从酸化海带灰浸出液中提取碘,产物中不会生成氢氧根离子,正确的离子方程式为:2I-+2H++H2O2═I2+2H2O,故C错误;
D.碘易溶于四氯化碳等有机溶剂,碘水中加入CCl4发生萃取,得到I2的CCl4溶液,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】已知:①CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(g) ΔH1=-a kJ·mol-1
O2(g)===CO2(g)+2H2O(g) ΔH1=-a kJ·mol-1
②CO(g)+![]() O2(g)===CO2(g) ΔH2=-b kJ·mol-1
O2(g)===CO2(g) ΔH2=-b kJ·mol-1
③H2(g)+![]() O2(g)===H2O(g) ΔH3=-c kJ·mol-1
O2(g)===H2O(g) ΔH3=-c kJ·mol-1
④H2(g)+![]() O2(g)===H2O(l) ΔH4=-d kJ·mol-1
O2(g)===H2O(l) ΔH4=-d kJ·mol-1
下列叙述正确的是( )
A. 由上述热化学方程式可知ΔH3>ΔH4
B. H2的燃烧热为c kJ·mol-1
C. CH3OH(g)===CO(g)+2H2(g) ΔH=( a- b-2c)kJ·mol-1
D. 当CO和H2的物质的量之比为1∶2时,其完全燃烧生成CO2和H2O(l)时,放出Q kJ热量,则混合气中CO的物质的量为![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用反应Cu+2FeCl3===CuCl2+2FeCl2设计成如下图所示的原电池,回答下列问题:

①写出正极电极反应式:___________
②图中X溶液是_______,原电池工作时,盐桥中的_____(填“阳”、“阴”)离子向X溶液方向移动。
(2)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池。
2Fe2++I2设计成如图所示的原电池。

请回答下列问题:
①反应开始时,乙中石墨电极上发生______(填“氧化”或“还原”)反应,电极反应式为_____。
②电流表读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨电极上的反应式为_________。
(3)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是
A. 2SO2+O2![]() 2SO3△H=-196.6kJ·mol-1
2SO3△H=-196.6kJ·mol-1
B. H2(g)+![]() O2(g)====H2O(l)△H=-285.8kJ·mol-1
O2(g)====H2O(l)△H=-285.8kJ·mol-1
C. 2H2(g)+O2(g)====2H2O(l)△H=-571.6kJ
D. C(s)+O2(g)====CO2(g)△H=+393.5KJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某简单微粒核外有18个电子,下列关于该微粒的说法正确的是( )
A.该微粒一定具有氧化性B.该微粒一定具有还原性
C.该微粒一定既无氧化性又无还原性D.该微粒可能有氧化性,也可能有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语或模型正确的是
A. 苯分子的比例模型:
B. CO2的电子式:![]()
C. Cl-离子的结构示意图:
D. 乙烯的结构式:CH2=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
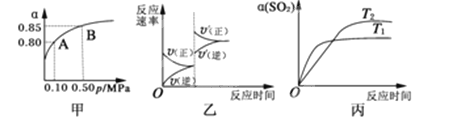
A. 由图甲推断,B点SO2的平衡浓度为0.3 mol·L-1
B. 由图甲推断,A点对应温度下该反应的平衡常数为800(L·mol-1)
C. 达平衡后,若增大容器容积,则反应速率变化图像可以用图乙表示
D. 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com