
【题目】下列过程只需要破坏共价键的是
A. 晶体硅熔化B. 碘升华C. 熔融Al2O3D. NaCl溶于水
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在由铜片、锌片和200mL稀硫酸组成的原电池中,若锌片口只发生电化学腐蚀,当在铜片上共放出2.24L气体(标准状况)时,稀H2SO4刚好用去一半,则产生这些气体消耗锌g,共有mol电子通过导线,原H2SO4溶液的浓度是mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下表数据:
化学式 | 电离平衡常数(25℃) |
HCN | K=5.0×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7 ,K2=4.7×10-11 |
① 25℃时,等浓度的四种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液,pH由大到小的顺序为_______(填序号)。
② 将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性,则c(HCN)、c(H+)、c(OH-)、c(CN-)、c(Na+)浓度排序为_______,c(HCN)+c(CN-)_____(填“>”、“<”或“=”)0.1mol/L。
③ 相同条件下,取等体积等pH的a.HCN溶液 b. CH3COOH溶液 c.H2CO3溶液,各稀释100 倍,稀释后的溶液,其pH大小关系为_______(填序号)。
④ 25℃时,将体积为Va,pH = 13的某一元强碱与体积为Vb,pH=2的某二元强酸混合,若所得溶液的pH=11,则Va:Vb=________。
(2)温度为T℃时水的离子积常数为Kw,该温度下,将浓度为amol/L的H2SO4与bmol/L的一元碱AOH等体积混合。则可判断溶液呈中性的是_______(填序号)。
①混合溶液的pH=7 ②c(SO42-)=![]() c(A+)
c(A+)
③混合溶液中c(H+)c(OH-)=Kw ④ 混合溶液中c(OH-)=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的说法中,正确的是
A. 胶体和溶液均能导电
B. 胶体和溶液的本质区别是能否产生丁达尔效应
C. 明矾水解生成Al(OH)3胶体,可用作净水剂
D. 布朗运动是胶体粒子特有的运动方式,可以据此区分胶体与溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 °C时,将1.0 L WmolL-1的CH3COOH溶液与0.1 mol NaOH固体混合,充分反应后向混合液中通(加)入HC1气体或NaOH固体,溶液pH随加入HC1或NaOH的物质的量的变化如图所示。下列叙述正确的是
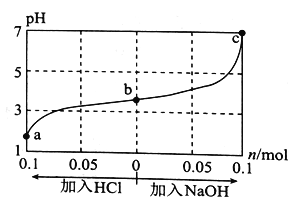
A. a、b、c对应的混合液中,水的电离程度由大到小的顺序是,a>b>c
B. c点混合液中:c(Na+)>c(CH3COO-)
C. 加入NaOH过程中,![]() 的值减小
的值减小
D. 若忽略体积变化,则25 °C时CH3COOH的电离常数 K=![]() ×10-7 molL-1
×10-7 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 蒸馏操作中若实验中途发现未添加碎瓷片,应立即补加
B. 点燃可燃气体前必须验纯
C. 不慎将浓碱溶液沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液
D. 蒸发皿在加热时应均匀加热再集中加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A.任何晶体中,若含有阳离子也一定含有阴离子
B.离子晶体中可能含有共价键
C.离子晶体中只含有离子键不含有共价键
D.分子晶体中只存在分子作用力,不含有其他化学键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com