
【题目】(1)已知下表数据:
化学式 | 电离平衡常数(25℃) |
HCN | K=5.0×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7 ,K2=4.7×10-11 |
① 25℃时,等浓度的四种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液,pH由大到小的顺序为_______(填序号)。
② 将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性,则c(HCN)、c(H+)、c(OH-)、c(CN-)、c(Na+)浓度排序为_______,c(HCN)+c(CN-)_____(填“>”、“<”或“=”)0.1mol/L。
③ 相同条件下,取等体积等pH的a.HCN溶液 b. CH3COOH溶液 c.H2CO3溶液,各稀释100 倍,稀释后的溶液,其pH大小关系为_______(填序号)。
④ 25℃时,将体积为Va,pH = 13的某一元强碱与体积为Vb,pH=2的某二元强酸混合,若所得溶液的pH=11,则Va:Vb=________。
(2)温度为T℃时水的离子积常数为Kw,该温度下,将浓度为amol/L的H2SO4与bmol/L的一元碱AOH等体积混合。则可判断溶液呈中性的是_______(填序号)。
①混合溶液的pH=7 ②c(SO42-)=![]() c(A+)
c(A+)
③混合溶液中c(H+)c(OH-)=Kw ④ 混合溶液中c(OH-)=![]()
【答案】 b>a >d> c c(HCN) >c (Na+) >c (CN-) >c (OH- )>c( H+) 略 b> c> a 1:9 ②④
【解析】(1)①由表中电离平衡常数可知酸性大小:CH3COOH>H2CO3>HCN>HCO![]() (相应的酸根离子分别为CH3COO-、HCO
(相应的酸根离子分别为CH3COO-、HCO![]() 、CN-、CO
、CN-、CO![]() ),酸性越强,其盐溶液中酸根离子水解程度越大,故等浓度的四种溶液:a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液、d.NaHCO3溶液,pH由大到小的顺序为b>a>d>c。②反应后得到等浓度的HCN与NaCN的混合溶液,由溶液显碱性可推知CN-水解程度大于HCN的电离程度,故溶液中有关微粒的浓度大小为c(HCN)>c(Na+)>c(CN-)> c(OH-)>c(H+);等体积混合后有关粒子的浓度变为原来的一半,根据原子守恒可知c(HCN)+c(CN-)=0.1 mol·L-1。③酸越弱,稀释同样倍数,其pH改变越小,因此相同条件下,取等体积等pH的a.HCN溶液,b.CH3COOH溶液,c.H2CO3溶液,各稀释100倍,稀释后的溶液pH大小关系为b>c>a。④混合后溶液pH=11,说明混合后溶液中c(OH-)=10-3mol·L-1,故由题意得
),酸性越强,其盐溶液中酸根离子水解程度越大,故等浓度的四种溶液:a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液、d.NaHCO3溶液,pH由大到小的顺序为b>a>d>c。②反应后得到等浓度的HCN与NaCN的混合溶液,由溶液显碱性可推知CN-水解程度大于HCN的电离程度,故溶液中有关微粒的浓度大小为c(HCN)>c(Na+)>c(CN-)> c(OH-)>c(H+);等体积混合后有关粒子的浓度变为原来的一半,根据原子守恒可知c(HCN)+c(CN-)=0.1 mol·L-1。③酸越弱,稀释同样倍数,其pH改变越小,因此相同条件下,取等体积等pH的a.HCN溶液,b.CH3COOH溶液,c.H2CO3溶液,各稀释100倍,稀释后的溶液pH大小关系为b>c>a。④混合后溶液pH=11,说明混合后溶液中c(OH-)=10-3mol·L-1,故由题意得![]() =10-3,解得Va∶Vb=1∶9。(2)因温度不一定是25 ℃,故pH=7时溶液不一定呈中性;由c(SO
=10-3,解得Va∶Vb=1∶9。(2)因温度不一定是25 ℃,故pH=7时溶液不一定呈中性;由c(SO![]() )=
)=![]() c(A+)及电荷守恒可知溶液中c(H+)=c(OH-),则溶液一定呈中性;无论溶液呈酸性、中性还是碱性,混合溶液中总存在c(H+)·c(OH-)=Kw;混合溶液中c(OH-)=
c(A+)及电荷守恒可知溶液中c(H+)=c(OH-),则溶液一定呈中性;无论溶液呈酸性、中性还是碱性,混合溶液中总存在c(H+)·c(OH-)=Kw;混合溶液中c(OH-)=![]() mol·L-1,可说明混合溶液中c(H+)=c(OH-),则溶液一定呈中性。
mol·L-1,可说明混合溶液中c(H+)=c(OH-),则溶液一定呈中性。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 1H,2H,3H互为同素异形体 B. O2、O3互为同位素
C. 乙烷、乙烯互为同系物 D. 正丁烷和异丁烷互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g)![]() Z(g)+W(s) △H>0,下列叙述正确的是
Z(g)+W(s) △H>0,下列叙述正确的是
A. 在容器中加入氩气,反应速率不变
B. 加入少量W,逆反应速率增大
C. 升高温度,正反应速率增大,逆反应速率减小
D. 将容器的体积压缩,可增大活化分子的百分数.有效碰撞次数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇、氧气和强碱溶液作电解质的手机电池中的反应为2CH3OH+3O2+40H-![]() 2CO32-+6H2O,有关说法正确的是
2CO32-+6H2O,有关说法正确的是
A. 放电时,CH3OH 参与反应的电极为正极
B. 放电时,负极电极反应:CH3OH+8OH--6e-=CO32-+6H2O
C. 标准状况下,通入的11.2LO2完全反应有1mol电子转移
D. 充电时电解质溶液的pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CaCO3和盐酸反应的化学方程式为CaCO3(s)+2HCl===CaCl2+H2O+CO2↑,下列措施中可使生成CO2的速率加快的是(不考虑CaCO3与盐酸接触面积改变的影响)
A. 加大CaCO3的量 B. 加大盐酸的浓度
C. 加大盐酸的量 D. 减小CaCl2的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯酚等有机物为原料制备高分子材料(M)和药物(N)的一种合成路线如下(部分反应条件略去)
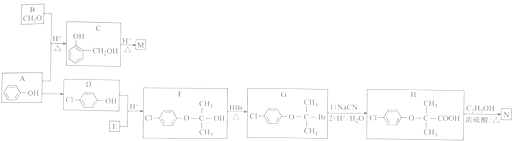
已知: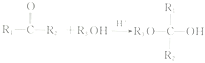 (R1、R2表示氢原子或烃基,R3表示烃基)。
(R1、R2表示氢原子或烃基,R3表示烃基)。
请回答下列问题:
(1)M的结构简式为_______________。E的化学名称为_________________。
(2)C中官能团的电子式为__________________。
(3) D的核磁共振氢谱中有_________________组吸收峰。
(4) F→G的反应类型为____________________。
(5)H→N的化学方程式为_____________________________。
(6)同时满足下列条件的H的同分异构体有_________________种(不考虑立体异构)。
①苯环上连有两个取代基
②能与FeCl3溶液发生显色反应
③能与NaHCO3溶液反应生成气体
(7)已知:一个碳原子上连有两个羟基的有机物不能稳定存在。参照上述合成路线和信息,以甲醇和乙醇为原料(其他无机试剂任选),设计制备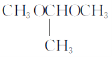 的合成路线:_________________。
的合成路线:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0
B. 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
C. CH3COOH 溶液加水稀释后,溶液中![]() 的值增大
的值增大
D. Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解向左移动,溶液的pH 增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com