
| 32 |
| 5 |
| 3 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
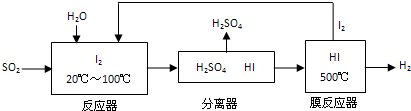
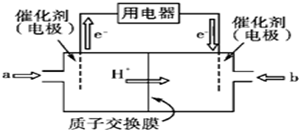
查看答案和解析>>
科目:高中化学 来源: 题型:
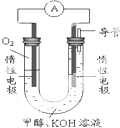 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).
某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).查看答案和解析>>
科目:高中化学 来源: 题型:
| X | |||
| Y | Z | W |
| A、原子半径:Y<Z<W |
| B、气态氢化物的稳定性:X>Z |
| C、W的最高价氧化物与水反应形成的化合物是离子化合物 |
| D、X的气态氢化物的水溶液能与Y的最高价氧化物对应水化物发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com