
下列说法中正确的是
A.(2013·安徽)HCHO分子中既含σ键又含π键
B.(2013·安徽)CO2分子中的化学键为非极性键
C.(2013·四川)NH3分子中N原子的杂化轨道类型是sp2
D.(2013·重庆)沸点:PH3>NH3>H2O
科目:高中化学 来源: 题型:
已知X、Y和Z三种元素的原子序数之和等于42,X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。
请回答下列问题:
(1)X元素原子基态时的电子排布式为_______________,该元素的符号是________;
(2)Y元素原子的价层电子排布图为________________________________________,
该元素的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于原电池的叙述中,正确的是( )
A.原电池能将化学能转变为电能
B.原电池负极发生的电极反应是还原反应
C.原电池在工作时其正极不断产生电子并经外电路流向负极
D.原电池的电极只能由两种不同的金属构成
查看答案和解析>>
科目:高中化学 来源: 题型:
人工合成化合物NH5 可改写成HN4H,能和水反应:NH5 + H2O==NH3.H2O + H2↑.下列说法正确的是( )
A. NH5属于离子化合物,该反应中水做氧化剂
B.该反应属于氧化还原反应,NH5既是氧化剂又是还原剂
C.该反应不属于氧化还原反应,属于复分解反应
D.标准状况下每生成22.4LH2时,转移2NA电子
查看答案和解析>>
科目:高中化学 来源: 题型:
KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸l h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处:
(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、稳定性好的物质如:草酸)溶液测定其浓度。
回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体? 。
(2)通常使用的酸性高锰酸钾溶液,是在高锰酸钾溶液滴入 (填试剂名称)使溶液呈酸性。
(3)若准确称取W g草酸晶体(H2C2O4·2H2O)溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。
①配制高锰酸钾溶液必须用到的玻璃仪器除了烧杯和玻璃棒外还有
②写出滴定过程中对应的离子方程式
KMnO4溶液的物质的量浓度为________________mol/L;
③若滴定前平视,滴定后俯视,则测得的浓度值将________(填“偏高”或“偏低”)
④达到滴定终点的现象为
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是____________;N2H4分子中氮原子轨道的杂化类型是________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g)
ΔH=-1 038.7 kJ·mol-1
若该反应中有4 mol N—H键断裂,则形成的π键有____________ mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在________(填标号)。
a.离子键 b.共价键
c.配位键 d.范德华力
(2)(2012·新课标全国节选)ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
①H2Se的酸性比H2S________(填“强”或“弱”)。气态SeO3分子的立体构型为____________,SO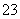 离子的立体构型为____________。
离子的立体构型为____________。
②H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
H2SeO4比H2SeO3酸性强的原因:______________________________________
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
A.NH4Cl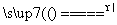 NH3↑+HCl↑
NH3↑+HCl↑
B.NH3+CO2+H2O===NH4HCO3
C.2NaOH+Cl2===NaCl+NaClO+H2O
D.2Na2O2+2CO2===2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D. 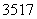 Cl与
Cl与 Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
要设计一套实验室利用液体和液体加热反应制备气体的装置,现设计了五步操作,正确的程序是( )
①将蒸馏烧瓶固定在铁架台上
②将酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定铁圈,放好石棉网
③用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集器中
④检查装置的气密性(利用对固定装置微热的方法检查气密性)
⑤在蒸馏烧瓶上装好分液漏斗,连接好导气管
A.②①⑤④③ B.④①②⑤③
C.①②⑤④③ D.①⑤④②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com