
����Ŀ����ҵ�Ʊ��������Ҫ��Ӧ֮һΪSO2��O2��Ӧ����SO3����ش��������⣺

��1��SO2��O2��Ӧ����SO3�ķ�Ӧ���̵������仯��ͼ1��ʾ����ͼ�����߱仯��֪���÷�ӦΪ___(������������������������Ӧ��
��2��������������ʱ����ͬ�¶���SO2��ת������ʱ��ı仯�����ͼ2��ʾT1___(����>������<����T2��
��3��ij��ʵ���У����ݻ�Ϊ2L�ĺ��º����ܱ�������ͨ��2molSO2��bmolO2����Ӧ�����в������ʵ����ʵ����淴Ӧʱ��ı仯��ͼ3��ʾ��
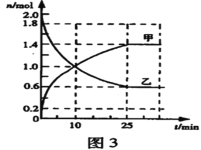
�ټ�Ϊ___(�ѧʽ����ͬ������Ϊ___��
��SO2��O2����SO3�ķ�Ӧ��___��Ӧ��(������������������������
��10minʱ��v��(SO2) _______ v��(SO2)��(����>������<������=����
�ܴӷ�Ӧ��ʼ��ƽ�⣬��Ӧ����v(SO3)=___��
�ݵ�b=___ʱ��O2��SO2��ת������ȡ�
��Ӧ�ﵽƽ��ʱ��SO2��ת����Ϊ___��
���𰸡����� > SO3 SO2 ���� > 0.028molL-1min-1 1 70%
��������
(1)��Ӧ�����������������������������ӦΪ���ȷ�Ӧ��
(2)������������ʱ�������ȹ���ƽ�������ߣ��¶ȸߣ�ѹǿ���з�����
(3)�ٸ���ͼ��������淴Ӧ�Ľ��У������ʵ������ӣ���������ҵ����ʵ������٣��Ƿ�Ӧ�
����ͼ3��֪��25min��SO2��SO3����ɱ��ֲ��䣬�ﵽƽ��״̬����Ӧ�ﲻ��ȫ�������ꣻ
��10minʱ����Ӧ���ҽ��У�v��(SO2)>v��(SO2)��
�ܸ������ʵļ��㹫ʽ���м��㣻
�ݵ�SO2��O2��Ͷ�ϱȵ��ڷ���ʽ�ļ�����ʱ���������ʵ�ת������ȣ�
����ת���ʵļ��㹫ʽ���м��㡣
(1)��ͼ1��ʾ���μӷ�Ӧ��SO2��O2�������������ɵ�SO3����������ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
(2)������������ʱ����ͬ�¶���SO2��ת������ʱ��ı仯�����ͼ2��T1��Ӧ���ʿ죬�ȴﵽƽ�⣬��Ӧ�¶ȸߣ�T1>T2��
�ʴ�Ϊ��>��
(3)���淴Ӧ�Ľ��У������ʵ������ӣ����������ΪSO3���ҵ����ʵ������٣��Ƿ�Ӧ���ΪSO2��
�ʴ�Ϊ��SO3��SO2��
����ͼ3��֪��25min��SO2��SO3����ɱ��ֲ��䣬�ﵽƽ��״̬��SO2��O2����SO3�ķ�Ӧ�ǿ��淴Ӧ��
�ʴ�Ϊ�����棻
��10minʱ��SO2�м��ٵ����ƣ��������������ɵ�����v��(SO2)>v��(SO2)��
�ʴ�Ϊ��>��
�ܴӷ�Ӧ��ʼ��ƽ�⣬��Ӧ����v(SO3)=![]() =0.028molL-1min-1��
=0.028molL-1min-1��
�ʴ�Ϊ��0.028molL-1min-1��
�ݵ�SO2��O2��Ͷ�ϱȵ��ڷ���ʽ�ļ�����ʱ���������ʵ�ת������ȣ���2oml:bmol=2:1������b=1ʱ��O2��SO2��ת������ȣ�
�ʴ�Ϊ��1��
��Ӧ�ﵽƽ��ʱ��SO2��ת����Ϊ![]() 70%��
70%��
�ʴ�Ϊ��70%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ij����ѧ�����������һ����������ȫ����������أ���ṹ��ͼ��ʾ��

�����йظõ�طŵ�ʱ��˵����ȷ����(����)
A.a������������Ӧ
B.�����ĵ缫��ӦʽΪFeOx��2xe��=Fe��xO2��
C.����22.4 L(��״��)�������뷴Ӧ�����·����4 mol����ת��
D.�����淢���ķ�ӦΪxH2O(g)��Fe=FeOx��xH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3mol A��2.5mol B�����2L���ݵ��ܱ������У������¶Ȳ��䷢���ķ�Ӧ���£�3A(g)��B(g)![]() xC(g)��2D(g)����Ӧ5min�ﵽƽ�⣬������ѹǿ��С�����D��ƽ����Ӧ����Ϊ0.1mol/(L��min)�����н�����ȷ���ǣ� ��
xC(g)��2D(g)����Ӧ5min�ﵽƽ�⣬������ѹǿ��С�����D��ƽ����Ӧ����Ϊ0.1mol/(L��min)�����н�����ȷ���ǣ� ��
A.A��ƽ����Ӧ����Ϊ0.10mol/(L��s)
B.ƽ��ʱ��B��ת����Ϊ20%
C.ƽ��ʱ��C��Ũ��Ϊ0.125mol/L
D.ƽ��ʱ��������ѹǿΪԭ����0.8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�������Ա���������̴���ϵ��ѡ����ʵ���˼�ͪ���ǰ��ķ�������C-H�Ļ��Ӧ�����ø÷�Ӧ�Ʊ�������J�ĺϳ�·�����£�

��֪��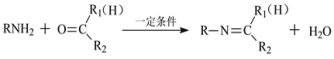
�ش��������⣺
��1��A�й����ŵ�������______��F�Ļ�ѧ������______��
��2��C��D����E�Ļ�ѧ����ʽΪ_____________��
��3��G�Ľṹ��ʽΪ________��
��4����D����F��E��H����J�ķ�Ӧ���ͷֱ���______��_____��
��5�����㻯����K��E��ͬ���칹�塣��K�ܷ���������Ӧ����K���ܵĽṹ��____�֣����к˴Ź��������������Ľṹ��ʽΪ______����дһ�֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ��ж���������Ԫ��W��X��Y��Z��ԭ��������������W��Һ̬����Ӧ���ں��������ǻ����ɵ���Ҫȼ�ϣ�XԪ��ԭ�ӵ��������������ڲ��������3����Ԫ��Y����Ȼ����ֻ���Ի���̬���ڣ�����Ԫ��Y����ɺ�ˮ�������ʵ�����Ԫ���У���������Ϊ�ڶ���ZԪ��ԭ����ͬ������ԭ�Ӱ뾶��С������˵��������ǣ� ��
A.Z�ĵ�����W��Y�ĵ��ʶ��ܷ�Ӧ���ҷ�Ӧ��Z�ĵ��ʶ���������
B.X�ĵ�����Y�ĵ����ڳ��������·�Ӧ���ɻ�����ף��õ���ʽ��ʾ���γɹ���Ϊ��![]()
C.Y��W�����γ�ԭ�Ӹ�����Ϊ1��1�Ļ������ң�������ˮ��Ӧ���������
D.W��X�γɵĺ��м��Թ��ۼ��Ļ����ﲻֻ��һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��NaClO2������Ư���ԣ���ҵ����ClO2������NaClO2�Ĺ���������ͼ��ʾ��

����˵������ȷ����
A.����a�IJ����������ˡ�ϴ�Ӻ���
B.������������NaClO2�����ӷ���ʽΪ2ClO2+H2O2=2ClO2��+2H+ +O2��
C.��ҵ�Ͻ�ClO2�����Ƴ�NaCIO2����,����ҪĿ���DZ������������
D.ͨ��Ŀ�����Ŀ�������ϳ�ClO2��ʹ�䱻������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ȼ����ijЩ�����������±���

��ʵ�����������ͼװ���Ʊ�һ�ȼ��飺
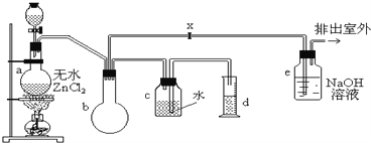
�Ʊ�װ�õķ�Һ©����ʢ�м״�����ƿ��ʢ��Ũ���ᡣ
����д���пհף�
(1)�Ʊ�һ�ȼ���Ļ�ѧ����ʽ��__________���÷�Ӧ���ڷ�Ӧ__________��
(2)װ��e�п��ܷ�����Ӧ�Ļ�ѧ����ʽ��__________________��
(3)�����������CH3Cl�ķ����ǣ���e���ݳ��ڵ�ȼCH3Cl���壬���������ɫ������������ȼ����������������������������HCl����CH3Clȼ�յĻ�ѧ����ʽ��____________��
(4)װ��b��������________��ijѧ���ڹرջ���x�����������ʵ��ʱ���֣��ռ���һ�������������������ĵļ״���Ũ������������ۼ�������ࣨװ�õ�������û�����⣩����ԭ����________��ʵ�������d���ռ�����Һ���к���___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ�������Դ������һ�ֻ���ԭ�ϣ��ڹ����з�������Ҫ�����á�
��1���������Ʊ������ѵ�ԭ��֮һ����ͨ������;����ȡ��
��.2CO2��g��+6H2��g��CH3OCH3��g��+3H2O��g�� ��H
��.2CO��g��+4H2��g��CH3OCH3��g��+H2O��g�� ��H
��֪����CO2��g��+3H2��g��CH3OH��g��+H2O��g�� ��H1=akJmol-1
��CO��g��+H2O��g��CO2��g��+H2��g�� ��H2=bkJmol-1
��CH3OCH3��g��+H2O��g��2CH3OH��g�� ��H3=ckJmol-1
��Ӧ�����H____kJmol-1
��2������Ҳ���Ժ�CO2�ڴ�������Cu/ZnO��������ֱ������CH3OH������ʽ����CO2��g��+3H2��g��CH3OH��g��+H2O��g�����ֽ�1molCO2��g����3molH2��g������2L���������з�����Ӧ����ͬʱ����ڲ��CH3OH����������� ��CH3OH�����¶ȣ�T���Ĺ�ϵ��ͼ��ʾ��
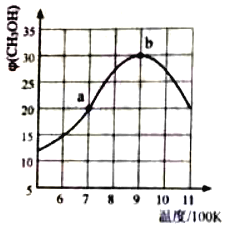
�پ���10min�ﵽa�㣬��ʱCH3OH���������Ϊ20%����v��H2��=___��������λС������
��b��ʱ��CH3OH�������������ԭ����___��
��b��ʱ��������ƽ��ѹǿΪ P0��CH3OH���������Ϊ30%����Ӧ��ƽ�ⳣ��Kp=___����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����������
��a���b���v����a__b���������������=��������900Kʱ����˸����������ٳ�������ʵ�����CH3OH��H2O����ƽ�������CH3OH��___30%��
����900K���Ժ����д�ʩ����״����ʵ���____������ĸ��
a�����뺤�� b�������H2O c������ d���ı����
��3��H2�����Ի�ԭNO������Ⱦ����ӦΪ2NO��g��+2H2��g��N2��g��+2H2O��g�����÷�Ӧ���ʱ���ʽv=kc2��NO��c��H2����k�����ʳ�����ֻ���¶��йأ���������Ӧ���������У�
i.2NO��g��+H2��g��N2��g��+H2O2��g����H1��ii��H2O2��g��+H2��g��2H2O��g����H2��ѧ�ܷ�Ӧ�ֶಽ���У���Ӧ������һ�������ܷ�Ӧ���ʣ�����������Ӧ�У�����Ӧ�Ļ�ܽϵ͵���___���i����ii����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Ʒ���Ѿ����������ʣ������������Al2O3��Fe2O3��CuO����ѧ��ȤС���������ֽ�����������Է��룬�����Ƶ���Ӧ�Ĵ������������Һ��ʵ�鷽���������£�
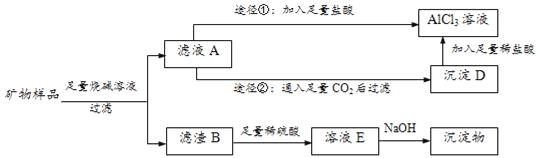
��1����Fe2O3��CuO����ɫ������___ɫ��___ɫ��
��2��д����ҺA����Ҫ���ʳɷ֣�___��
��3������ҺA��AlCl3��Һ�Тٺ͢�����;���������������������֮���������ǣ�___��
��4����ҺE�к������������ӣ���E�зֲ��μ�NaOH��Һ�������������Ⱥ���OH����ϣ������еڶ�λ����������ʹij���Լ���ΪѪ��ɫ�������Լ���___����������Ʒ������Ϊm1������Fe(OH)3������Ϊm2������Ʒ��Fe2O3����������Ϊ___����ʹFe3+������һ�������NaOH�������òⶨֵ��___������ƫ��������ƫ������������������
��5����Cu(OH)2����ϡ���ᣬȻ���Ƴɵ������壬��Ҫ�IJ����������ΰ�������Ũ����___��___��ϴ�ӡ���Ȼ����ȡ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com