
【题目】3mol A和2.5mol B混合于2L恒容的密闭容器中,保持温度不变发生的反应如下:3A(g)+B(g)![]() xC(g)+2D(g),反应5min达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论正确的是( )
xC(g)+2D(g),反应5min达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论正确的是( )
A.A的平均反应速率为0.10mol/(L·s)
B.平衡时,B的转化率为20%
C.平衡时,C的浓度为0.125mol/L
D.平衡时,容器内压强为原来的0.8倍
科目:高中化学 来源: 题型:
【题目】现有下列短周期元素性质的数据,回答下列问题:
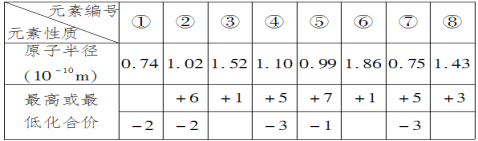
(1)元素③在周期表中位置是__;元素④与元素⑦相比较,气态氢化物较稳定的是__(填化学式);
(2)元素①是__(写元素符号),元素⑥是__(写元素符号),二者按照原子个数比为1∶1形成的化合物与水反应的化学方程式为:___。
(3)元素⑤与元素②的非金属性强弱顺序为__(写元素符号),元素⑤的单质通入到元素②的氢化物的水溶液中,反应的化学方程式为:___。
(4)用电子式表示元素①氢化物的形成过程___。写出元素⑦氢化物的电子式__;写出实验室制元素⑤单质的化学反应方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、环境密切相关。下列说法正确的是
A. 明矾在水中生成的![]() 胶体有吸附性,因此常用明矾对水进行消毒
胶体有吸附性,因此常用明矾对水进行消毒
B. 因汽油不完全燃烧使汽车尾气中含有少量氮氧化物
C. 液氨汽化吸收大量热,所以液氨常用作制冷剂
D. Al(OH)3具有很高的熔点,是优良的耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】闪烁着银白色光泽的金属钛(22Ti)因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域,号称“崛起的第三金属”。已知钛有48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是( )
A.上述钛原子中,中子数不可能为22
B.钛元素在元素周期表中处于第四周期
C.钛的不同同位素在元素周期表中处于不同的位置
D.钛元素属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《汉书景帝纪》记载,我国用锌的历史可追溯到西汉或更早。请回答:
(1)基态Zn原子的价层电子轨道表达式为___;占据最高能层的电子,其电子云轮廓图形状为____。
(2)与相邻元素Ga相比,元素Zn的第一电离能较大的原因为___。
(3)Zn2+可与CN-、二苯硫腙 等形成稳定配合物。
等形成稳定配合物。
①CN-的结构式为___。
②每个二苯硫腙分子中,采取sp2杂化的原子有___个。
(4)卤化锌的熔点如表所示:
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
①ZnCl2、ZnBr2、ZnI2的熔点呈表中变化规律的原因____。
②ZnF2的熔点远高于其它三种卤化锌,其原因为___。
(5)ZnS的某种晶胞结构如图所示。已知该晶体的密度为dg.cm-3,S2-和Zn2+半径分别为apm、bpm,阿伏伽德罗常数的数值为NA。
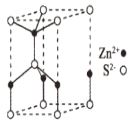
①Zn2+的配位数为___。
②该晶胞中离子的体积占晶胞体积的百分率为__(列式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确且能合理解释事实的是( )
A.将铜丝插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
B.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时问后,溶液变蓝:4H++4I-+O2=2I2+2H2O
C.向Mg(HCO3)2溶液中加入过量NaOH溶液,产生白色沉淀:Mg2++2HCO![]() +2OH-=MgCO3↓+2H2O
+2OH-=MgCO3↓+2H2O
D.向含0.1molFeBr2的溶液中通入0.1molCl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。

①若“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为____________。
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为________。
(2)工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+ 3H2(g)═CH3OH(g)+ H2O(g) △H1=-53.7kJ/mol,CH3OCH3(g)+H2O(g) ═ 2CH3OH(g) △H2=+23.4kJ/mol,则2CO2(g)+ 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的nCO2/nH2值变小
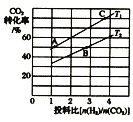
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。T1温度下,将6 mol CO2和12molH2充入2L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3) =___;KA、KB、KC三者之间的大小关系为_____。
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c (NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备硫酸的主要反应之一为SO2与O2反应生成SO3。请回答下列问题:

(1)SO2与O2反应生成SO3的反应过程的能量变化如图1所示。由图中曲线变化可知,该反应为___(填“放热”或“吸热”)反应。
(2)其他条件不变时,不同温度下SO2的转化率随时间的变化情况如图2所示T1___(填“>”或“<”)T2。
(3)某次实验中,在容积为2L的恒温恒容密闭容器中通入2molSO2和bmolO2,反应过程中部分物质的物质的量随反应时间的变化如图3所示。
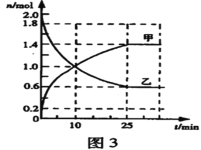
①甲为___(填化学式,下同),乙为___。
②SO2与O2生成SO3的反应是___反应。(填“可逆”或“不可逆”)
③10min时,v正(SO2) _______ v逆(SO2)。(填“>”、“<”或“=”)
④从反应开始到平衡,反应速率v(SO3)=___。
⑤当b=___时,O2与SO2的转化率相等。
⑥反应达到平衡时,SO2的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中发生反应:4A(s)+3B(g)2C(g)+D(g),2min后B减小了1.2mol.有关此反应的说法正确的是( )
A. 在 2min 内的反应速率,用 C 表示是 0.4mol/(Lmin)
B. 分别用 B、C、D 表示化学反应速率其比值是 3:2:1
C. 达到化学反应限度时,B 物质转化率为 100%
D. 向容器中增加 A 的投量,可以加快该反应的速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com