
【题目】现有下列短周期元素性质的数据,回答下列问题:
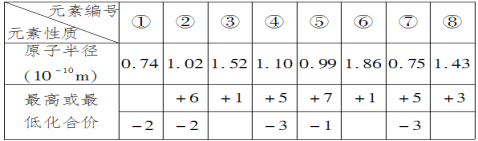
(1)元素③在周期表中位置是__;元素④与元素⑦相比较,气态氢化物较稳定的是__(填化学式);
(2)元素①是__(写元素符号),元素⑥是__(写元素符号),二者按照原子个数比为1∶1形成的化合物与水反应的化学方程式为:___。
(3)元素⑤与元素②的非金属性强弱顺序为__(写元素符号),元素⑤的单质通入到元素②的氢化物的水溶液中,反应的化学方程式为:___。
(4)用电子式表示元素①氢化物的形成过程___。写出元素⑦氢化物的电子式__;写出实验室制元素⑤单质的化学反应方程式__。
【答案】第二周期第ⅠA族 NH3 O Na 2Na2O2+2H2O=4NaOH+O2↑ Cl>S Cl2+H2S=2HCl+S↓ ![]()
![]() MnO2+4HCl(浓)
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
【解析】
短周期元素①的化合价为-2,为O元素;②的化合价为+6、-2,为S元素;③⑥化合价都是+1,原子半径③<⑥,得③为Li元素、⑥为Na元素;④⑦化合价都是+5、-3,原子半径④>⑦,得④为P元素、⑦为N元素;⑤的化合价为+7、-1,为Cl元素; ⑧的化合价为+3,根据半径大于P和O,在第三周期,为Al元素。
(1)元素③为Li元素,在周期表中位置是第二周期第ⅠA族;④为P元素、⑦为N元素,同主族元素从上到下非金属性逐渐减弱,非金属性越强气态氢化物越稳定,则气态氢化物较稳定的是NH3;
(2)元素①是O,元素⑥是Na,二者按照原子个数比为1∶1形成的化合物为Na2O2,与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;
(3)元素②为S元素,⑤为Cl元素,同周期元素从左到右非金属性逐渐增强,强弱顺序为Cl>S;元素⑤的单质Cl2通入到元素②的氢化物H2S的水溶液中,反应的化学方程式为Cl2+=2HCl+S↓;
(4)元素①氢化物为水,水是共价化合物,用电子式表示的形成过程为![]() ;元素⑦氢化物为氨气,电子式为
;元素⑦氢化物为氨气,电子式为![]() ;实验室制Cl2用MnO2和浓盐酸,反应方程式为MnO2+4HCl(浓)
;实验室制Cl2用MnO2和浓盐酸,反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是
A.将1 L 2 mol·L-1的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA
B.标准状况下,2.24L的H2O中氢原子数目大于2NA
C.1 L 0.1 mol/L NaHSO4溶液中含有0.1 NA个HSO4-
D.78gNa2O2与过量的CO2充分反应转移电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列说法正确的是( )
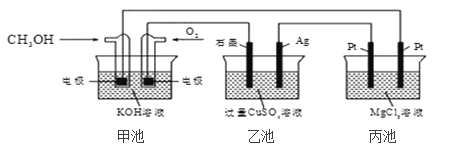
A. 若将乙池电解液换成 AgNO3 溶液,则可以实现在石墨棒上镀银
B. 甲池通入 CH3OH 的电极反应式为 CH3OH+6e+2H2O═CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量 Cu(OH)2 固体,能使 CuSO4 溶液恢复到原浓度
D. 甲池中消耗 224mL(标准状况下)O2,此时丙池中理论上产生 1.16g 固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2(g)+O2(g)![]() 2SO3(g)+196.64kJ,则下列判断正确的是
2SO3(g)+196.64kJ,则下列判断正确的是
A.2SO2(g)+O2(g)![]() 2SO3(l)+Q,Q>196.64kJ
2SO3(l)+Q,Q>196.64kJ
B.2molSO2气体和过量的O2充分反应放出196.64kJ热量
C.1LSO2(g)完全反应生成1LSO3(g),放出98.32kJ热量
D.使用催化剂,可以减少反应放出的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )

A. 该有机物的分子式为C7H7O3
B. 该有机物能发生取代、加成和氧化反应
C. 1mol该有机物最多能与2mol H2发生加成反应
D. 该有机物的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘。向反应后的溶液中滴入酚酞,溶液变为红色。
(1)试写出该反应的化学方程式(Ⅰ):_____。
(2)该反应体系中还伴随着化学反应(Ⅱ):I2(aq) + I-(aq)![]() I3-(aq)。反应Ⅱ的平衡常数表达式为:____。
I3-(aq)。反应Ⅱ的平衡常数表达式为:____。
(3)根据如图,计算反应Ⅱ中3-18s内用I2表示的反应速率为_____。
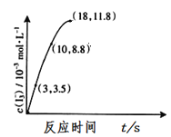
(4)为探究Fe2+对上述O3氧化I-反应的影响,将O3通入含Fe2+和I-的混合溶液中。试预测因Fe2+的存在可能引发的化学反应(请用文字描述,如:“碘离子被臭氧氧化为碘单质”)① ______。② _____;该反应的过程能显著降低溶液的pH,并提高反应(Ⅰ)中Ⅰ-的转化率,原因是:____ 。
(5)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后以淀粉为指示剂,用一定浓度的I2溶液进行滴定。综合上述各步反应及已有知识,可推知氧化性强弱关系正确的是____(填序号)。
a. Fe3+> I2 b. O3> Fe3+ c. I2> O2 d. I2>SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3mol A和2.5mol B混合于2L恒容的密闭容器中,保持温度不变发生的反应如下:3A(g)+B(g)![]() xC(g)+2D(g),反应5min达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论正确的是( )
xC(g)+2D(g),反应5min达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论正确的是( )
A.A的平均反应速率为0.10mol/(L·s)
B.平衡时,B的转化率为20%
C.平衡时,C的浓度为0.125mol/L
D.平衡时,容器内压强为原来的0.8倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com