
【题目】LED产品具有耗电量低、寿命长的特点。下图是氢氧燃料电池驱动LED屏发光的装置,下列有关叙述错误的是( )
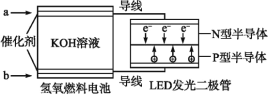
A.a处通入的气体是氢气,电极反应式为H2+2OH-2e=2H2O
B.装置中电子的流向为a极→N型半导体→P型半导体→b极
C.装置中的能量转化至少涉及三种形式的能量
D.图中![]() 表示来自氢氧燃料电池中的K+的移动方向
表示来自氢氧燃料电池中的K+的移动方向
科目:高中化学 来源: 题型:
【题目】有机物的反应往往伴随副反应发生,因此需要分离提纯。有一种水果香精的合成步骤如下:
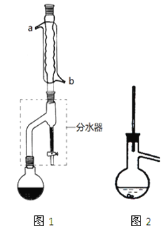
Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸(乙酸)和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好。在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min。
Ⅱ分离提纯:
①当分水器中的液面不再升高时,冷却,放出分水器中的水,把反应后的溶液与分水器中的酯层合并,转入分液漏斗中,用10mL10%碳酸钠溶液洗至酯层无酸性(pH=7),充分振荡后静置,分去水层。
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥(生成MgSO47H2O晶体)
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品,主要试剂及产物的物理常数如下:
化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
制备过程中还可能与的副反应有2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
根据以上信息回答下列问题:
(1)写出合成乙酸正丁酯的化学方程式____________。
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从______(填a或b)管口通入。
(3)步骤①中碳酸钠溶液的作用主要是除去硫酸、_________、___________。
(4)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先___________(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有___________________杂质。
(5)步骤③的常压蒸馏,需控制一定的温度,你认为在_______中加热比较合适(请从下列选项中选择)。
A.水 B.甘油(沸点290℃) C.石蜡油(沸点200~300℃) D.沙子
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的转化率约为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为___。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式___,配制的FeCl3溶液应保持酸性,原因是__。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+I3-
②I3-+2S2O32-=S4O62-+3I-
现取20.00mL含Cu2+的溶液,加入足量的KI充分反应后,用0.1000mol·L-1的Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00mL,此溶液中Cu2+的浓度为__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
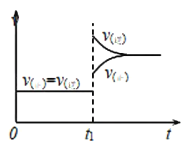
【题目】对于反应![]() ,减小压强,平衡向______(填“正反应”或“逆反应”)方向移动,平衡混合气体的平均相对分子质量在平衡移动时______(填“是”或“否”)发生改变,其原因是____________;下图是反应速率与时间的关系图,
,减小压强,平衡向______(填“正反应”或“逆反应”)方向移动,平衡混合气体的平均相对分子质量在平衡移动时______(填“是”或“否”)发生改变,其原因是____________;下图是反应速率与时间的关系图,![]() 时刻引起正、逆反应速率变化的原因可能是____________(写一条合理原因)。
时刻引起正、逆反应速率变化的原因可能是____________(写一条合理原因)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然黄铜矿主要成分为![]() (含
(含![]() ),为测定该黄铜矿的纯度,某同学设计了如下实验:
),为测定该黄铜矿的纯度,某同学设计了如下实验:
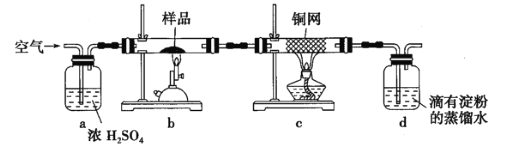
称取硏细的黄铜矿样品![]() 煅烧,生成
煅烧,生成![]() 、
、![]() 、
、![]() 和
和![]() 气体,实验后取
气体,实验后取![]() 中溶液的1/10置于锥形瓶中,用
中溶液的1/10置于锥形瓶中,用![]() 标准碘溶液进行滴定,初读数为
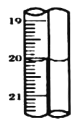
标准碘溶液进行滴定,初读数为![]() ,末读数如图所示,完成下列填空:
,末读数如图所示,完成下列填空:
(1)实验中称量样品所需定量仪器为____________。
(2)装置![]() 的作用是____________。
的作用是____________。
(3)上述反应结束后,仍需通一段时间的空气,其目的是____________。
(4)滴定时,标准碘溶液所耗体积为______![]() 。用化学方程式表示滴定的原理:____________。
。用化学方程式表示滴定的原理:____________。
(5)计算该黄铜矿的纯度____________。
(6)工业上利用黄铜矿冶炼铜产生的炉渣(含![]() ,
,![]() ,
,![]() ,
,![]() )可制备
)可制备![]() 。选用提供的试剂:稀盐酸、稀硫酸、
。选用提供的试剂:稀盐酸、稀硫酸、![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,设计实验验证炉渣中含有
溶液,设计实验验证炉渣中含有![]() 。所选试剂为____________,证明炉渣中含有
。所选试剂为____________,证明炉渣中含有![]() 的实验方案为____________。
的实验方案为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保水剂是一种强吸水树脂,能在短时间内吸收自身重量几百倍至上千倍的水分。聚丙烯酸钠就是一种高吸水性树脂。下面是丙烯合成聚丙烯酸钠的化工流程:

(1)上述反应中属于加成反应的有____________,反应⑧的反应类型为____________;
(2)若(1)的反应条件为通过溴的四氯化碳溶液,请写出A的结构简式____________;D中官能团名称是____________。
(3)请写出C→D的化学反应方程式__________________。
(4)![]() 是
是![]() 的同系物,式量比
的同系物,式量比![]() 大14,写出2种符合下列要求的
大14,写出2种符合下列要求的![]() 的同分异构体:①链状分子;②与新制氢氧化铜在加热条件下反应生成砖红色沉淀;③与
的同分异构体:①链状分子;②与新制氢氧化铜在加热条件下反应生成砖红色沉淀;③与![]() 溶液混合后滴入酚酞,加热,溶液颜色变浅。__________、___________
溶液混合后滴入酚酞,加热,溶液颜色变浅。__________、___________
(5)检验反应(4)是否全部转化的实验方案__________________。
(6)丙酮(![]() )是一种常用的化工试剂,请设计一条由丙烯制备丙酮的合成路线。(合成路线常用的表示方式为:
)是一种常用的化工试剂,请设计一条由丙烯制备丙酮的合成路线。(合成路线常用的表示方式为:![]() )
)
____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的叙述正确的是
A. 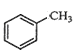 苯环上的一个氢原子被含1个氯原子取代,所得产物有5种
苯环上的一个氢原子被含1个氯原子取代,所得产物有5种
B. 丁烷(C4H10)的二氯取代物只能有4种
C. 菲的结构式为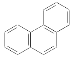 ,其一硝基取代物有10种
,其一硝基取代物有10种
D. 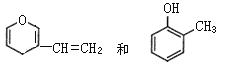 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为合成1丁醇,查阅资料得知一条合成路线:CH3CH===CH2+CO+H2→CH3CH2CH2CHO![]() CH3CH2CH2CH2OH,CO的制备原理:HCOOH
CH3CH2CH2CH2OH,CO的制备原理:HCOOH![]() CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
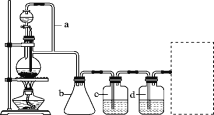
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2丙醇,从中选择合适的试剂制备氢气、丙烯。写出化学方程式:______________________________________________。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是________、________;c和d中盛装的试剂分别是________、________。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________(填序号)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是________。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1丁醇粗品,为纯化1丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)―→RCH(OH)SO3Na↓;②沸点:乙醚 34 ℃,1丁醇 118 ℃,并设计出如下提纯路线:
粗品![]() 滤液
滤液![]() 有机层
有机层![]() 1丁醇、乙醚
1丁醇、乙醚![]() 纯品
纯品
试剂1为________,操作1为________,操作2为________,操作3为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)③、④、⑧的原子半径由大到小的顺序为:______(用元素符号回答)。
(2)⑤、⑥、⑦的最高价氧化物对应的水化物碱性由强到弱的顺序是:______。(用化学式回答)
(3)②和⑨两种元素成的某化合物是一种常见的有机溶剂,则该化合物的电子式为:______ 。
(4)④和⑧形成的化合物属于______晶体(填“离子”、“分子”、“原子”),该晶体中微粒间的作用力为:______。
(5)②形成的单质与③形成的最高价氧化物的水化物的浓溶液发生化学反应的方程式为:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com