
| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ•mol-1 | |
| D. | 完全燃烧16g甲醇,生成一氧化碳和水时放出的热量为221.82 kJ |
分析 A.1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热;
B.放热反应中反应物的总能量大于生成物的总能量;
C.根据盖斯定律计算,反应热与计量数成正比,方程式的计量数加倍,则反应热也加倍;
D.根据CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H1=-726.64kJ•mol-1 方程式计算.
解答 解:A.1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热,2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1,则CO的燃烧热为283.0 kJ•mol-1,故A错误;
B.放热反应中反应物的总能量大于生成物的总能量,所以2 mol CO和1 mol O2的总能量比2 mol CO2的总能量高,故B错误;
C.已知:①CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H1=-443.64kJ•mol-1 ②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1根据盖斯定律①+②×$\frac{1}{2}$得CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H1=-726.64kJ•mol-1 ,方程式的计量数加倍,则反应热也加倍则2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ•mol-1,故C正确;
D.CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H1=-726.64kJ•mol-1 ,完全燃烧16g甲醇,生成一氧化碳和水时放出的热量为726.64kJ,故D错误;
故选C.
点评 本题考查了反应热的计算、盖斯定律的应用、热化学方程式的书写等,题目难度不大,注意把握盖斯定律的含义.


科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3溶液中加入甲酸无明显现象产生 | |
| B. | 25℃时,向甲酸中加入NaOH溶液,HCOOH的电离程度和K均增大 | |
| C. | 向碳酸中加入NaHCO3固体,c(H+)减小 | |
| D. | 向0.1 mol•L-1甲酸中加入蒸馏水,c(H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用广泛pH试纸测得Na2CO3溶液的pH为10.5 | |
| B. | 用10mL量筒量取5.20mL盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用25mL的酸式滴定管量取14.80mL KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- | |
| B. | 肯定存在的离子是Na+、K+、SO32-、Br- | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤④改用BaCl2溶液和盐酸的混合溶液,则对溶液中离子的判断无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯乙烯 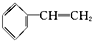 | B. | 苯甲醛 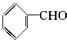 | C. | 苯乙酮 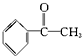 | D. | 苯酚 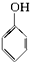 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7×10-3 mol/L | B. | 1.9×10-4mol/L | C. | 1.7×10-4mol/L | D. | 5.7×10-5mol/L. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
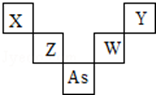 第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )| A. | W的氧化物对应的水化物必是强酸 | |
| B. | X的原子半径比As原子半径小,两者原子序数之差为29 | |
| C. | Z的氧化物可与Y的氢化物水溶液不会发生化学反应 | |
| D. | 图中五种元素均是非金属元素,并且Y的非金属性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com