
某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色;再向橙黄色溶液中滴加BaCl2溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出。该溶液可能大量存在的一组离子是 ( )
A.K+、H+、NO3-、Na+ B.H+、Br-、SO![]() 、Na+
、Na+
C.SO![]() 、Br-、OH-、Fe3+ D.H+、Br-、SO
、Br-、OH-、Fe3+ D.H+、Br-、SO![]() 、K+
、K+
科目:高中化学 来源: 题型:阅读理解


| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
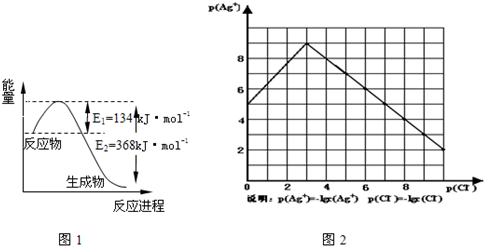
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
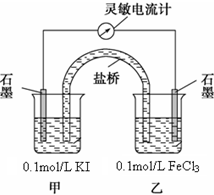 某研究性学习小组为证明2Fe3++2I-?2Fe2++I2为可逆反应(即反应存在一定的限度),设计如下几种方案.已知FeF63-是一种无色的稳定的络离子.
某研究性学习小组为证明2Fe3++2I-?2Fe2++I2为可逆反应(即反应存在一定的限度),设计如下几种方案.已知FeF63-是一种无色的稳定的络离子.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com