
 .
.分析 A、B、C、D、E为短周期元素,原子序数依次增大.B的最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则B为碳元素;C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X,则C为N元素,X为NH4NO3;A、B、D、E可组成化合物A2D2、B2A2、E2D2,它们都含有非极性共价键,其中A与E同主族,可推知A为H元素,D为O元素,E为Na,据此进行解答.
解答 解:A、B、C、D、E为短周期元素,原子序数依次增大.B的最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则B为碳元素;C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X,则C为N元素,X为NH4NO3;A、B、D、E可组成化合物A2D2、B2A2、E2D2,它们都含有非极性共价键,其中A与E同主族,可推知A为H元素,D为O元素,E为Na,
(1)C为N元素,在周期表中的位置是:第二周期VA族,B的最高价氧化物为CO2,电子式为 ,
,
故答案为:第二周期VA族; ;
;
(2)X为NH4NO3,其水溶液中NH4+水解:NH4++H2O?H++NH3•H2O,显酸性,溶液中各种离子浓度由大到小的顺序为:c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:酸;NH4++H2O?H++NH3•H2O;c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(3)H、C、O、Na四种元素组成的化合物中原子个数最少的化合物的化学式为:HCOONa,
故答案为:HCOONa.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,推断元素是解题关键,需要学生熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
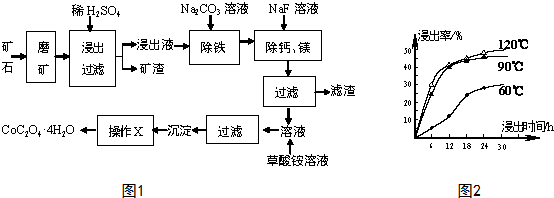
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X、Y位于第ⅠA族,则X、Y可能与氧元素形成原子个数比为1:1或2:1的化合物 | |
| B. | 若X、Y位于第三周期,则X、Y形成的化合物可能是离子化合物,也可能是共价化合物 | |
| C. | 若气态HnX的沸点高于HnY,则X、Y只能位于元素周期表的第ⅥA族 | |
| D. | 若X、Y位于周期表的同一周期,则最高价含氧酸的酸性可能是HnXOm>HaYOb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOCH2CH33+H2O | |
| B. | CH2═CH2+HBr→CH3CH2Br | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 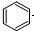 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$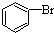 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生析氢腐蚀时,0.56gFe反应 转移电子数为0.03NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 1molH2O2分子中的非极性共价键 1NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
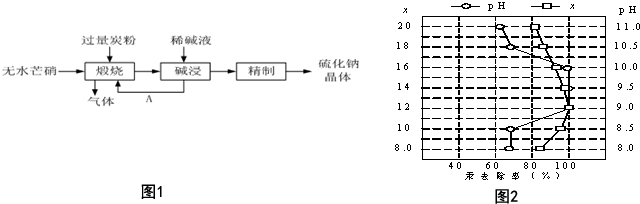
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③ | C. | ②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- | |
| B. | 含有0.1 mol•L-1Fe3+的溶液中:K+、Mg2+、I-、SO42- | |
| C. | 能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- | |
| D. | c(Al3+)=0.5 mol•L-1的溶液中:Na+、K+、AlO2-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com