
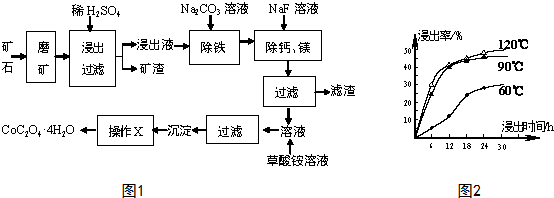
分析 水钴矿磨矿将矿石粉碎,增大接触面积,加快反应速率,加入稀硫酸,矿渣为SiO2,滤液中含有:CoSO4、Fe2(SO4)3、MgSO4、CaSO4,加入碳酸钠,除去Fe2(SO4)3,加入氟化钠,除去钙镁,过滤得主要含CoSO4的溶液,加入草酸铵,通过沉淀、过滤、洗涤、干燥得到四水合草酸钴,
(1)根据浸出率与时间和温度的关系及生产成本分析;
(2)根据原子守恒配平方程式;
(3)$\frac{c(Ca{\;}^{2+})}{c(Mg{\;}^{2+})}$=$\frac{Ksp(CaF{\;}_{2})}{Ksp(MgF{\;}_{2})}$;
(4)根据流程图中加入的物质分析,该沉淀中吸附易溶于水的离子;得到的沉淀要进行洗涤和干燥,才能得到较纯净、干燥的物质;
(5)放电时,该电池是原电池,正极上得电子发生还原反应,依据负极电极材料和题干信息分析计算.
解答 解:(1)根据图知,时间越长浸出率越高,温度越高,浸出率越高,但浸出12小时后,浸出率变化不大,90℃和120℃浸出率变化不大,且时间过长、温度过高导致成本较大,所以最佳的浸出时间为12小时,最佳的浸出温度为90℃,
故答案为:12;90;
(2)根据原子守恒配平方程式,所以其方程式为:3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6 (SO4)4(OH)12↓+5Na2SO4+6CO2↑,
故答案为:3,6,6,1,5,6;
(3)$\frac{c(Ca{\;}^{2+})}{c(Mg{\;}^{2+})}$=$\frac{Ksp(CaF{\;}_{2})}{Ksp(MgF{\;}_{2})}$=$\frac{1.1×10{\;}^{-10}}{7.40×10{\;}^{-11}}$=1.5,
故答案为:1.5;
(4)该沉淀中吸附易溶于水的离子,根据流程图知,溶液中含有SO42-、NH4+、Na+、F-,所以沉淀上含有SO42-、NH4+、Na+、F-,得到的沉淀要进行洗涤和干燥才能得到较纯净、干燥的物质,
故答案为:SO42-、NH4+、Na+、F-;洗涤、干燥;
(5)放电时,该电池是原电池,正极上得电子发生还原反应,电极反应式为:CoO2+Li++e-=LiCoO2,充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,所以负极为LiC6中Li的化合价为0价,若放电时有1mol e-转移,CoO2+Li++e-=LiCoO2,正极质量增加为1molLi+的质量=1mol×7g/mol=7g;
故答案为:0;7.
点评 本题考查难溶电解质的溶解平衡、电极反应式的书写、物质的分离和提纯等知识点,难点是(3)题,明确溶度积常数的含义是解此题关键,电极反应式的书写是学习难点,要结合电解质溶液的酸碱性书写,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | c(Al3+)=0.1mol/L的溶液中:Na+、K+、HS-、SO42- | |
| B. | 使酚酞呈红色的溶液中:K+、Ba2+、I-、NO3- | |
| C. | 由水电离出的c(H+)=10-13mol/L的溶液中:Na+、HCO3-、Cl-、Br- | |
| D. | 加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①② | C. | ①③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
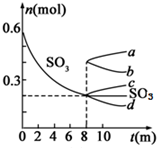 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -488.3 kJ/mol | B. | -244.15 kJ/mol | C. | 488.3 kJ/mol | D. | 244.15 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入Ba(NO3)2溶液中能生成BaSO4沉淀 | |
| B. | 在Si02+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2C0的反应中,Si02是氧化剂 | |
| C. | 生铁在潮湿的空气中主要发生析氢腐蚀 | |
| D. | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色气体,说明该钾盐是K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
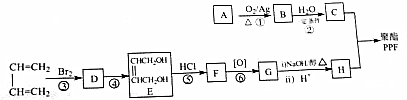

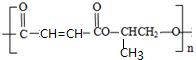 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com