
| A. | HNO3 | B. | Cu | C. | SO2 | D. | NH4NO3 |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质.
解答 解:A.HNO3为化合物,其水溶液能导电,则HNO3属于电解质,故A错误;
B.Cu是单质,所以Cu既不是电解质也不是非电解质,故B错误;
C.二氧化硫的水溶液能导电,原因是二氧化硫和水反应生成亚硫酸,亚硫酸能电离出自由移动的阴阳离子而使溶液导电,亚硫酸是电解质,二氧化碳是非电解质,故C正确;
D.NH4NO3溶于水或熔融状态导电的化合物,属于电解质,故D错误;
故选C.
点评 本题考查了电解质的判断,难度不大,注意电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸铁与氢氧化钡溶液反应Ba2++SO42-═BaSO4↓ | |
| B. | 钾和水反应K+2H2O═K++2OH-+H2↑ | |
| C. | 小苏打与烧碱溶液反应HCO3-+OH-═CO32-+H2O | |
| D. | 苏打与盐酸反应HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,化学反应速率一定加快 | |
| B. | 其它条件不变,温度越高,反应速率越快 | |
| C. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| D. | 增加反应物的量,反应速率一定加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、Cl2O7都是酸性氧化物 | B. | 水银、水玻璃都是混合物 | ||
| C. | 干冰、可燃冰都是分子晶体 | D. | HD、HCHO都是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2>Fe2+>I2 | B. | Br2>Fe3+>I2 | C. | I2>Br2>Fe3+ | D. | Fe3+>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
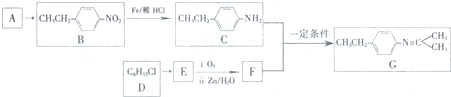
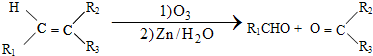
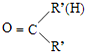 $\stackrel{一定条件}{→}$R-N=C
$\stackrel{一定条件}{→}$R-N=C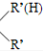 +H2O
+H2O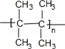 .
.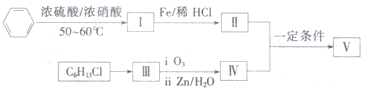
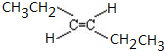 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溴水中的溴 | 乙醇萃取 | 溴在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去乙烷中的乙烯 | 酸性高锰酸钾液体、洗气 | 乙烯可以用碱性高锰酸钾溶液除去氯化钠在水中的溶解度很大 |
| D | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
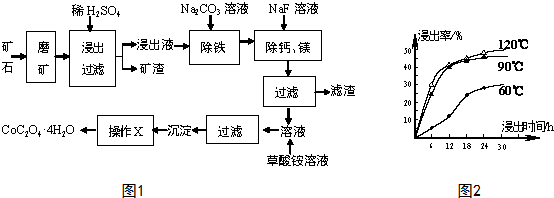
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com