
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| 步骤I: ① . 步骤II:配制与0.1 mol/L Fe(NO3)3 溶液所含c (H+)、 c (NO3-) 相同的溶液,取适量此溶液放入到新制备的银镜中. | ② ,乙同学的推测 成立;反之,则不成立. |

分析 (1)Fe(NO3)3为强酸弱碱盐,铁离子水解能使溶液呈酸性;
(2)先测得Fe(NO3)3溶液的pH值,然后才能配制与0.1 mol/L Fe(NO3)3 溶液所含c (H+)、c (NO3-) 相同的溶液,该条件下NO3-也能氧化单质Ag,可以看银在其中是否溶解加以证明;
(3)Fe3+如果氧化Ag,则会被银还原成亚铁离子,通过检验亚铁离子的存在可以证明Fe3+能够氧化单质 Ag;
(4)在Fe3+与Ag反应构成的原电池中,银发生氧化反应作负极,则石墨作正极,当指针归零后,向左侧U型管中滴加几滴 FeCl2浓溶液,指针向右偏转,则左侧电极为负极,银电极为正极,发生还原反应,Fe3+和Ag反应生成银离子和亚铁离子,当指针归零后,向右侧U型管中滴加数滴饱和NaCl溶液,生成氯化银沉淀,溶液中银离子浓度下降,银单质可继续被氧化,银作负极,据此答题;
解答 解:(1)Fe(NO3)3为强酸弱碱盐,铁离子水解能使溶液呈酸性,反应的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,
故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(2)先测得Fe(NO3)3溶液的pH值,然后才能配制与0.1 mol/L Fe(NO3)3 溶液所含c (H+)、c (NO3-) 相同的溶液,将银放入所含c (H+)、c (NO3-) 相同的溶液中,若银镜溶解,则说明该条件下NO3-也能氧化单质Ag,
故答案为:①测定0.1 mol/L Fe(NO3)3溶液的pH;②银镜溶解;
(3)Fe3+如果氧化Ag,则会被银还原成亚铁离子,通过检验亚铁离子的存在可以证明Fe3+能够氧化单质 Ag,具体操作为取反应后溶液少量于试管中,滴加几滴K3[Fe(CN)6]溶液,若产生蓝色沉淀,则证明有Fe2+产生,证实了Fe3+能氧化单质银,
故答案为:取反应后溶液少量于试管中,滴加几滴K3[Fe(CN)6]溶液,若产生蓝色沉淀,则证明有Fe2+产生,证实了Fe3+能氧化单质银;
(4)在Fe3+与Ag反应构成的原电池中,银发生氧化反应作负极,则石墨作正极,当指针归零后,向左侧U型管中滴加几滴 FeCl2浓溶液,指针向右偏转,则左侧电极为负极,银电极为正极,发生还原反应,Fe3+和Ag反应生成银离子和亚铁离子,当指针归零后,向右侧U型管中滴加数滴饱和NaCl溶液,生成氯化银沉淀,溶液中银离子浓度下降,银单质可继续被氧化,银作负极,可观察到指针向左偏转,
①根据上面的分析可知,K闭合时,指针向左偏转,石墨作正极,
故答案为:正极;
②当指针归零后,向左侧U型管中滴加几滴 FeCl2浓溶液,发现指针向右偏转,银电极为正极,发生还原反应,银电极的反应式为Ag++eˉ=Ag,
故答案为:Ag++eˉ=Ag;
③Fe3+和Ag反应的离子方程式为Fe3++Ag?Ag++Fe2+,
故答案为:Fe3++Ag?Ag++Fe2+;
④向右侧U型管中滴加数滴饱和NaCl溶液,生成氯化银沉淀,溶液中银离子浓度下降,银单质可继续被氧化,银作负极,可观察到指针向左偏转,
故答案为:指针向左偏转.
点评 本题考查盐类的水解、反应原理的探究、原电池原理的分析等知识,侧重考查学生分析能力、推理能力等,是对学生综合能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A | 将氯气通入品红溶液 | 溶液红色褪去 | 氯气具有漂白性 |
| B | 将铜粉加入1.0mol•L-1 的Fe2(SO4)3溶液中 | 溶液变蓝,有黑色固体出现 | 金属Fe比Cu活泼 |
| C | 用坩埚钳夹住用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点比较低 |
| D | 向盛有少量浓硝酸、稀硝酸的两支试管中分别加入一片大小相同的铜片 | 浓硝酸中铜片很快开始溶解,并放出红棕色气体;稀硝酸中过一会铜片表面才出现无色气体,气体遇空气变红棕色 | 浓硝酸氧化性强于稀硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
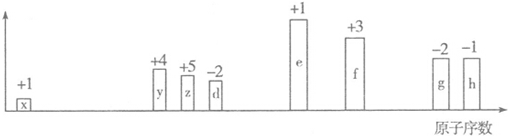
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=1.6 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质遇浓硝酸变黄 | |
| B. | 含钠元素的物质在火焰上灼烧产生黄色火焰 | |
| C. | pH试纸与某溶液接触变为红色 | |
| D. | 无色浓硝酸久置后变黄 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
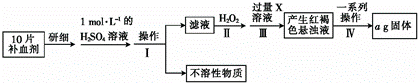
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com