
| 1 |
| 2 |
| ||
| ||
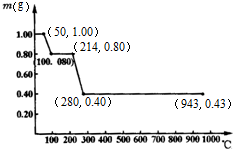
| 1 |
| 2 |
| 1 |
| 2 |
| 216 |
| 36 |
| 0.5×1.53 |
| 0.5×2.5 |
| ||
| ||


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
| 容器 | A | B |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| CH3OH(g)浓度(mol?L-1) | c1 | c2 |
| 反应能量变化 | 放出29.4kJ | 吸收akJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
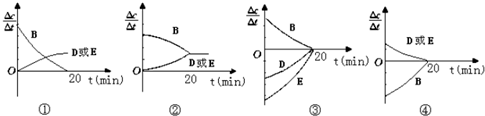
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、品红溶液 | B、石蕊溶液 |
| C、氯水 | D、碘化钾-淀粉溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
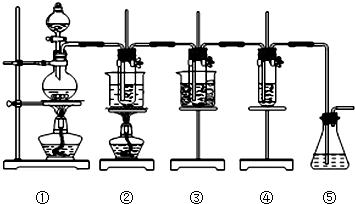
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变为 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤 |
| B、失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液,可以用碳酸铵溶液鉴别 |
| C、将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 |
| D、检验从火星上带回来的红色物体是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、医疗上常用体积分数为70%~75%的酒精作消毒剂 |
| B、用灼烧并闻气味的方法区别纯棉织物和纯毛织物 |
| C、某酸雨样品采集后放置一段时间,pH值变小,是因为水中又溶解了较多的CO2 |
| D、为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com