
【题目】下列离子方程式书写正确的是( )
A.铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑
B.Cu加到稀硫酸中:Cu+2H+═Cu2++H2↑
C.氯气与NaOH溶液反应:Cl2+OH-═Cl-+ClO-+H2O
D.碳酸钙与醋酸溶液反应:CaCO3+2H+═Ca2+ +CO2↑+H2O
科目:高中化学 来源: 题型:
【题目】以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法有不同的冶炼方法。火法炼铜:将辉铜矿(Cu2S)在空气中高温焙烧即可得到铜和一种还原性的气体。近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐。某工厂运用该原理生产铜和绿矾(FeSO47H2O)的工艺如下:
回答下列问题:
(1)火法炼铜发生的化学方程式:_________________________;
(2)湿发炼铜工艺流程中,为了提高酸浸时的进取率,本流程可采取的措施是________,试剂X为__________,其作用是_____________。
(3)试剂a为______________,试剂b为______________;
(4)配平反应1的化学方程式:____CuFeS2+___H2SO4+____O2=____CuSO4+____Fe2(SO4)3+____H2O
(5)已知:常温下Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.6×10-39。加入过量的试剂X调节pH=4时,可使溶液中的Fe3+转化为Fe(OH)3沉淀,则溶液中的c(Fe3+)=___________。若要此时不出现Cu(OH)2沉淀,则溶液中的Cu2+浓度最大不超过_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法不正确的是 ( )
A.淀粉、蛋白质、脂肪都属于营养物质
B.误食重金属盐,可立即喝牛奶或生蛋清进行解毒
C.新居室内装饰材料中缓慢释放出的甲醛等有机物会污染室内空气
D.棉线和毛线的主要成分都是纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对生石灰与水反应是显著放热反应进行了实验探究,在除了用手触摸式竹壁感觉发热外,还设计了下列几个可行性方案。
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,看到的现象是______,说明反应放热。(下列装置中支撑及捆绑等仪器己略去)

乙方案:将盛放有生石灰的小试管插入带支管的试管中,支管接①或②,用胶头滴管向小试管中缓缓滴入水,看到的现象是(接①)________(接②)________,说明反应放热。
丙方案:用胶头滴管向盛放有生石灰且带支管的试管中滴加水,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是______________,说明反应放热,其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝合金质优体轻,又不易锈蚀,被大量用于航空工业、造船工业、日用化工等领域。下列关于镁铝合金性质的叙述中,正确的是( )
A.此合金的熔点比镁和铝的熔点都高
B.此合金能全部溶解于稀盐酸中
C.此合金能全部溶解于氢氧化钠溶液中
D.此合金的硬度比镁和铝的硬度都小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分某实验室需要配制480mL0.10mol/LNa2CO3溶液。
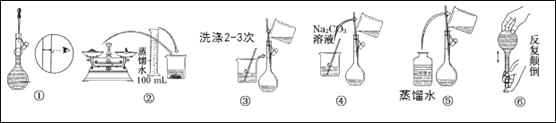
(1)实验时,应用托盘天平称取十水和碳酸钠晶体________g。
(2)所需玻璃仪器有:玻璃棒、烧杯、100mL量筒、__________、________。
(3)实验时图中所示操作的先后顺序为________ (填编号)。
(4)在配制过程中,下列操作对所配溶液浓度有无影响?__________(填“偏高”、“偏低”或“无影响”)
①称量时误用“左码右物”
②转移溶液后没有洗涤烧杯和玻璃棒
③向容量瓶加水定容时俯视液面
④摇匀后液面下降,再加水至刻度线
(5)若改用浓溶液稀释,需要量取2mol/LNa2CO3溶液____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.50ml,12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
B.常温常压下4.4g乙醛所含σ键数目为0.7NA
C.向浓H2SO4中通入H2S气体,1mol浓H2SO4转移电子数一定是2 NA
D.2.0gH218O与D2O的混合物中所含中子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关基本营养物质的说法中,正确的是( )
A.糖类、油脂、蛋白质都是由C、H、O三种元素组成
B.蔗糖和麦芽糖互为同分异构体
C.纤维素在人体内最终水解为葡萄糖
D.淀粉遇碘化钾溶液变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
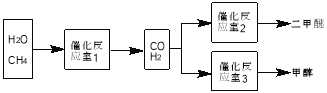
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0。将1.0molCH4和2.0molH2O通人反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=________。该反应平衡常数的表达式:_____________。
CO(g)+3H2(g) △H>0。将1.0molCH4和2.0molH2O通人反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=________。该反应平衡常数的表达式:_____________。
(2)已知:CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O(g) △H=-1323 KJ/mol;
2H2(g)+O2(g)=2H2O(g) △H=-484 KJ/mol;
CO的燃烧热:283KJ/mol。
在一定条件下,反应室2的可逆反应除生成二甲醚外还生成了气态水,该热化学方程式为_______________。(本题涉及的条件均在同一条件下)
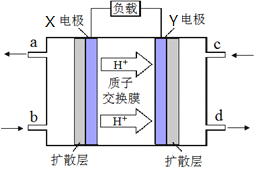
(3) 绿色电源“二甲醚-氧气燃料电池”的工作原理如右图所示,写出X电极的电极反应式_______________
(4)反应室3中在催化剂作用下发生如下反应:CO(g) +2H2(g) ![]() CH3OH(g)。对此反应进行如下研究:
CH3OH(g)。对此反应进行如下研究:
①在容积为1L的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图1所示。
则:该正反应的△H___________0(填“<”、“>”或“=")。
②在容积均为1L的a、b、c三个相同密闭容器中分别充入1mol CO和2mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5min时甲醇的体积分数如图2所示。下列说法正确的是_______________
A.a、b、c三容器5min时的正反应速率大小为:b>a>c
B.达到平衡时,a、b、c三容器中CO转化率为a>b>c
C.5min时,a、b、c三容器中的反应均可能达到平衡状态。
D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com