
【题目】二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
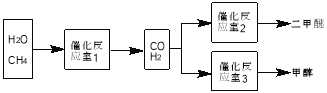
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0。将1.0molCH4和2.0molH2O通人反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=________。该反应平衡常数的表达式:_____________。
CO(g)+3H2(g) △H>0。将1.0molCH4和2.0molH2O通人反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=________。该反应平衡常数的表达式:_____________。
(2)已知:CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O(g) △H=-1323 KJ/mol;
2H2(g)+O2(g)=2H2O(g) △H=-484 KJ/mol;
CO的燃烧热:283KJ/mol。
在一定条件下,反应室2的可逆反应除生成二甲醚外还生成了气态水,该热化学方程式为_______________。(本题涉及的条件均在同一条件下)
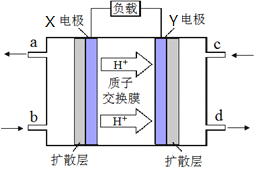
(3) 绿色电源“二甲醚-氧气燃料电池”的工作原理如右图所示,写出X电极的电极反应式_______________
(4)反应室3中在催化剂作用下发生如下反应:CO(g) +2H2(g) ![]() CH3OH(g)。对此反应进行如下研究:
CH3OH(g)。对此反应进行如下研究:
①在容积为1L的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图1所示。
则:该正反应的△H___________0(填“<”、“>”或“=")。
②在容积均为1L的a、b、c三个相同密闭容器中分别充入1mol CO和2mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5min时甲醇的体积分数如图2所示。下列说法正确的是_______________
A.a、b、c三容器5min时的正反应速率大小为:b>a>c
B.达到平衡时,a、b、c三容器中CO转化率为a>b>c
C.5min时,a、b、c三容器中的反应均可能达到平衡状态。
D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压
【答案】(1)0.0003mol·L-1·min-1;K=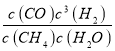 ;
;
(2)2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) △H=-211 KJ/mol
(3)(CH3)2O-12e-+3H2O=2CO2+12H+;
(4)①<;② BD
【解析】
试题分析:(1)10min末有0.1mol CO生成,根据方程式CH4(g)+H2O(g)CO(g)+3H2(g)可知,生成的氢气为0.1mol×3=0.3mol,容器的体积为100L,则10min内用氢气表示的平均速率v(H2)=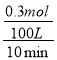 =0.0003mol/(Lmin);该反应平衡常数的表达式为K=
=0.0003mol/(Lmin);该反应平衡常数的表达式为K=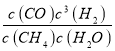 ,故答案为:0.0003 mol/(Lmin);
,故答案为:0.0003 mol/(Lmin);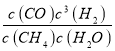 ;
;
(2)已知:①CO的燃烧热为283kJ/mol,则CO(g)+![]() O2(g)═CO2(g)△H=-283kJ/mol;②CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-1323kJ/mol,③2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,利用盖斯定理将①×2+③×2-②可得:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H= -2×(-283kJ/mol)+2×(-484kJ/mol)-(-1323kJ/mol)= -211kJ/mol,故答案为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-211kJ/mol;
O2(g)═CO2(g)△H=-283kJ/mol;②CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-1323kJ/mol,③2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,利用盖斯定理将①×2+③×2-②可得:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H= -2×(-283kJ/mol)+2×(-484kJ/mol)-(-1323kJ/mol)= -211kJ/mol,故答案为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-211kJ/mol;
(3)根据氢离子移动方向知,左边电极是负极,通入燃料二甲醚,右边电极是正极,通入氧化剂氧气,该燃料电池中,正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4e-+4H+=2H2O;负极的电极反应式为(CH3)2O-12e-+3H2O=2CO2+12H+,故答案为:(CH3)2O-12e-+3H2O=2CO2+12H+;
(4)①从图象可以看出,升高温度,甲醇的物质的量减少,说明正反应是放热反应,则△H<0,故答案为:<,
②A.升高温度,化学反应速率加快,故a、b、C三容器5min时的正反应速率大小为:c>b>a,故A错误;B.该反应为放热反应,升高温度,平衡逆向移动,故达到平衡时,a、b、c中CO转化率为a>b>c,故B正确;C.该反应为放热反应,升高温度,平衡逆向移动,故5min时,a中反应未达平衡,b、c中的反应达到平衡状态,故C错误;D.该反应为放热反应,升高温度,平衡逆向移动;反应后气体体积小于反应前,减小压强.平衡逆向移动,故将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压,故D正确,故答案为:BD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑
B.Cu加到稀硫酸中:Cu+2H+═Cu2++H2↑
C.氯气与NaOH溶液反应:Cl2+OH-═Cl-+ClO-+H2O
D.碳酸钙与醋酸溶液反应:CaCO3+2H+═Ca2+ +CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示的实验方案,请回答下列问题。
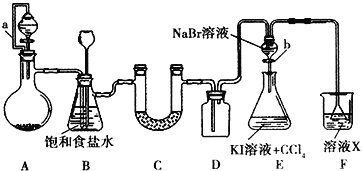
(1)A装置的分液漏斗中盛装浓盐酸,烧瓶中固体为重铬酸钾(K2Cr2O7),还原产物是(CrCl3),写出A中反应的离子方程式____________________________________。
(2)B装置有两个作用,分别是除去氯气中的氯化氢、___________________________。拆去a导管的后果可能是_____________________________。
(3)U形管C中盛装的可以是______(填序号)。
①浓硫酸 ②碱石灰 ③无水CaCl2
(4)证明溴的非金属性比碘强的实验操作和现象是__________________________。
(5)E装置中进行的实验存在明显不足,不足之处是_______________________________,溶液X可以是______(填序号)。
①氢氧化钠溶液 ②亚硫酸钠溶液 ③亚硫酸氢钠溶液
④氯化亚铁溶液 ⑤硫氢化钠溶液 ⑥碳酸氢钠溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊二烯是一种化工原料,有如下转化关系:

已知:①![]() ,
,
②![]() .
.
回答下列问题:
(1)A 的名称(系统命名)是 .
(2)B 的结构简式是 .
(3)上述物质中互为同系物的是 (填化合物代号).
(4)F 生成PHB 的化学方程式是 .
(5)E 的同分异构体中,既能发生银镜反应,也能与碳酸氢钠溶液反应的共有 种(不考虑立体异构).
(6)F 除了合成PHB 外,还可经过 (填反应类型)、聚合三步反应合成![]() (一种类似有机玻璃的塑料).
(一种类似有机玻璃的塑料).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法不正确的是( )
A. 鸡蛋清中加浓硝酸微热后变黄
B. 将苯滴入溴水中,振荡后水层接近无色
C. 蛋白质水解能得到氨基酸
D. 苯与乙烯都能使高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是( )
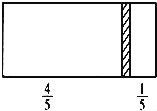
A.右边CO与CO2分子数之比为1:3
B.右侧气体密度是相同条件下氢气密度的18倍
C.右侧CO的质量为1.75g
D.若隔板处于距离右端![]() 处,其他条件不变,则前后两次压强之比为25:24
处,其他条件不变,则前后两次压强之比为25:24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测
知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )
A.K3C60中只有离子键
B.K3C60中不含共价键
C.该晶体在熔融状态下能导电
D.C60与12C互为同素异形体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com