
| A. | 测得0.1mol/L的氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 在H2O2溶液中,滴加FeCl3溶液产生气泡:2H2O2+2Cl-=2H2O+O2↑+Cl2↑ | |
| C. | 用CuCl2溶液做导电性试验,灯泡发光:CuCl2=Cu2++2Cl- | |
| D. | 向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑:Cu(OH)2 (s)+S2-?CuS (s)+2 OH- |
分析 A.一水合氨为弱电解质,不能完全电离;
B.在氯化铁催化作用下,过氧化氢分解生成氧气和水;
C.氯化铜为电解质,可电离;
D.CuS溶解度比氢氧化铜小,可生成CuS.
解答 解:A.测得0.1mol/L的氨水的pH为11,说明一水合氨为弱电解质,不能完全电离,电离方程式为NH3•H2O?NH4++OH-,故A正确;
B.在氯化铁催化作用下,过氧化氢分解生成氧气和水,应为2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,故B错误;
C.氯化铜为电解质,可电离,溶液导电,故C正确;
D.CuS溶解度比氢氧化铜小,可生成CuS,发生Cu(OH)2 (s)+S2-?CuS (s)+2 OH-,故D正确.
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重弱电解质的电离、难溶电解质的溶解平衡等应的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 99 | B. | 67 | C. | 32 | D. | 166 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
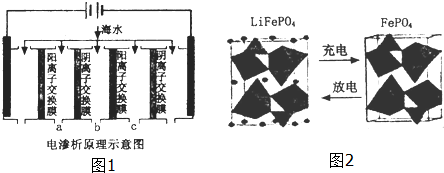
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C02与CaO化合是放热反应,则CaC03分解是吸热反应 | |
| B. | 只有分解反应才是吸热反应 | |
| C. | 使用催化剂的反应是吸热反应 | |
| D. | 凡需加热的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的晶体模型: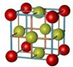 | |
| B. | 铍原子最外层的电子云图: | |
| C. | 次氯酸的结构式:H-O-Cl | |
| D. | CH3CHOHCH(CH3)2名称:2-3-二甲基丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,10L pH=1的硫酸溶液中含有的H+数为NA | |
| B. | 将58.5g NaCl溶于1.00L水中,所得NaCl溶液的浓度为1.00mol•L-1 | |
| C. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| D. | 1molAl3+含有的核外电子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com