
【题目】下列变化中,不需要破坏化学键的是
A. 碘升华 B. 碳酸氢钠受热分解 C. 氯化氢溶于水 D. 氯化钠熔化
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为原子序数递增的四种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(关系图中“—”相连的两种物质能发生反应)。下列判断正确的是

A. X是元素周期表中非金属性最强的元素 B. Z位于元素周期表第3周期IA族
C. 四种原子中,Y原子半径最小 D. W的简单阴离子可能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素在生活中有广泛应用,根据所需知识回答下列问题。
(1)氟元素基态原子的价电子排布图:_________,卤族元素位于元素周期表______区。
(2)在一定浓度的氢氟酸溶液中,部分溶质以二分子缔合(HF)2形式存在,使HF分子缔合的作用力是_______________。
(3)BF3常温下是气体,有强烈的接受弧电子对的倾向。BF3分子的立体构型为______,固态时的晶体类型是_______,BF3与NH3相遇立即生成白色固体,写出该白色固体物质的结构式并标注出其中的配位键_____。
(4)根据下表提供的数据判断,熔点最高、硬度最大的是_______(填化学式)。
离子晶体 | NaF | MgF2 | AlF3 |
晶格能(KJ·mol-1) | 923 | 2957 | 5492 |
(5)已知NaClO2晶体中阴离子为V型,ClO2-中氯原子的弧电子对数是______,ClO2-中氯原子的杂化轨道类型为_____,HClO4比HClO2酸性强的原因是_______。
(6)CaF2晶胞如下图所示。已知:NA为阿伏伽德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的密度可表示为_____g·cm-3。
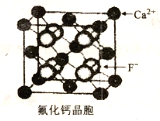
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:

(1)甲池中通入CH4电极的电极反应为___________________________________。
(2)乙池中A(石墨)电极的名称为________(填“正极”、“负极”或“阴极”、“阳极”), 乙池中总反应式为____________________________________ 。
(3)当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为______mL(标准状况),丙池中______(填“C”或“D”)极析出_______g铜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱镁矿(主要成分为MgCO3、含少量FeCO3、SiO2)制备高纯氧化镁的流程如下图所示:

己知:25℃时,指示剂变色pH范围和几种氢氧化物的ksp及pH的关系如下表:
指示剂 | 酚酞 | 甲基酸 |
变色范围(pH) | 8.2-10.0 | 3.1-4.4 |
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀时pH | 1.1 | 5.9 | 8.4 |
沉淀完全时pH | 3.7 | 9.6 | 10.2 |
溶度积常数 | 4×10-34 | 8×10-16 | 2×10-13 |
(1)操作II和III中涉及的分离方法分别是____________、_______________。
(2)残渣I的主要成分是____________,加入H2O2的过程中可观察到的现象是___________,其中发生的离子反应方程式是_________________________。
(3)MgSO4和木炭在800℃煅烧时,只生成MgO和两种气体,将混合气体通入NaOH溶液时,气体被完全吸收。煅烧时发生反应的化学方程式是_____________。
(4)采用滴定法测定溶液II与加入氨水的最佳体积比,可以减少氨水的消粍和Mg2+的损失。实验中应选取_______________指示剂,加入氨水是为了沉淀溶液II中的___________离子,若终点时该离子浓度=1.0×10-5mol·L-1,则溶液III的pH=_____________(己知:lg2=0.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1CH3COONa溶液pH =a,则下列说法正确的是
A.CH3COOH在常温下Ka数值约为l×101-2a
B.约有1.0×l0a-14 mol·L-1的水发生电离
C.加热后溶液pH <a
D.加少量水后,溶液pH >a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com