
�����£���1mol��CuSO4��5H2O(s)����ˮ��ʹ��Һ�¶Ƚ��ͣ���ЧӦΪ��H1����1mol��CuSO4(s)����ˮ��ʹ��Һ�¶����ߣ���ЧӦΪ��H2��CuSO4��5H2O���ȷֽ�Ļ�ѧ����ʽΪ��CuSO4��5H2O(s) ��CuSO4(s)+5H2O(l)�� ��ЧӦΪ��H3���������ж���ȷ����
A����H2����H3 B����H1����H3
C����H1+��H3 =��H2 D����H1+��H2 ����H3
B
��������
�����������������֪��CuSO4��5H2O(s)����ˮ���Ȼ�ѧ����ʽΪCuSO4��5H2O(s) Cu2+��aq��+SO42����aq��+5H2O(l)����H1��0��CuSO4(s)����ˮ���Ȼ�ѧ����ʽΪCuSO4(s)
Cu2+��aq��+SO42����aq��+5H2O(l)����H1��0��CuSO4(s)����ˮ���Ȼ�ѧ����ʽΪCuSO4(s) Cu2+��aq��+SO42����aq������H2��0�����ݸ�˹����֪��CuSO4��5H2O���ȷֽ���Ȼ�ѧ����ʽΪ��CuSO4��5H2O(s)
Cu2+��aq��+SO42����aq������H2��0�����ݸ�˹����֪��CuSO4��5H2O���ȷֽ���Ȼ�ѧ����ʽΪ��CuSO4��5H2O(s) CuSO4(s)+5H2O(l)�� ��H3=��H1����H2��0��A��������������֪����H2����H3������B��������������֪����H1����H3����ȷ��C��������������֪����H3=��H1����H2������D��������������֪����H1+��H2 ����H3������
CuSO4(s)+5H2O(l)�� ��H3=��H1����H2��0��A��������������֪����H2����H3������B��������������֪����H1����H3����ȷ��C��������������֪����H3=��H1����H2������D��������������֪����H1+��H2 ����H3������
���㣺�����H��С�Ƚϡ���˹���ɡ�


 ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д� �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���и߶��ϵ�һ��������⻯ѧ�Ծ��������棩 ���ͣ������
��CaCO3= CaO + CO2 ��H=+177.7kJ��mol-1
��C(s) + H2O(g) = CO(g) + H2(g) ��H=131.3kJ��mol-1
��1/2 H2SO4(aq) + NaOH(aq) =1/2Na2SO4(aq) + H2O(l) ��H= ��57.3kJ
��C(s) + O2(g) = CO2(g) ��H=��393.5kJ��mol-1
��CO(g) + 1/2O2(g) = CO2(g) ��H=��283kJ��mol-1
��HNO3(aq) + NaOH(aq) = NaNO3(aq) + H2O(l) ��H=��57.3kJ��mol-1
��1�������Ȼ�ѧ����ʽ�У�����ȷ���� ��
��2��������Ӧ�У���ʾȼ���ȵ��Ȼ�ѧ����ʽ�� ����ʾ�к��ȵ��Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���и�һ�ϵ�һ��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
Ϊ�˳�ȥ������Ca2+��Mg2+��SO42-����ɳ,����������ˮ,Ȼ��������в������ٹ��� �ڼӹ�����NaOH��Һ �ۼ��������� �ܼӹ���Na2CO3��Һ �ݼӹ�����BaCl2��Һ����ȷ������˳����
A. �٢ܢݢڢ� B. �ܢ٢ڢݢ� C. �ڢݢܢ٢� D. �ݢڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ��Ϫ�и߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����±��е��ĸ��Ȼ�ѧ����ʽ,�ж������ͱ����ȼ���ȷֱ���
���϶�һ�š�������ȼ�� | Һ��(H2) | ��2H2(g)+O2(g) ��2H2 (l)+O2(l) |
�������ˡ����ơ����ȼ�� | ���� (C3H8) | ��C3H8 (l)+5O2(g) ��C3H8(g)+5O2(g) |
A��571.6 kJ��mol-1,2 221.5 kJ��mol-1
B��241.3 kJ��mol-1,2 013.8 kJ��mol-1
C��285.8 kJ��mol-1,2 013.8 kJ��mol-1
D��285.8 kJ��mol-1,2 221.5 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ��Ϫ�и߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ�ǹ��ڷ�ӦA2(g)+3B2(g) = 2C(g)(����ӦΪ���ȷ�Ӧ)��ƽ���ƶ�ͼ�Σ�Ӱ��ƽ���ƶ���ԭ����
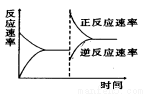
A�������¶ȣ�ͬʱ��ѹ��
B�������¶ȣ�ͬʱ��ѹ
C������Ӧ��Ũ�ȣ�ͬʱʹ�ô�����
D������Ӧ��Ũ�ȣ�ͬʱ��С������Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ��Ϫ�и߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵�����ʾ��������ȷ����
A�����������������������ֱ���ȫȼ�գ����߷ų���������
B����C�����ʯ����C��ʯī����H= -1.9KJ/mol ��֪�����ʯ��ʯī�ȶ�
C����101KPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8KJ����������ȼ�յ��Ȼ�ѧ����ʽΪ��2H2��g��+O2(g)=2H2O(l) ��H=+285.8KJ/mol
D����ˮ�м����������ƣ�ˮ�ĵ���̶ȼ�С��Kwֵ���䡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ��Ϫ�и߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�Ȼ�ѧ����ʽC(s)��H2O(g) == CO(g)��H2(g)����H ��+131.3kJ/mol��ʾ
A��̼��ˮ��Ӧ����131.3kJ����
B��1mol̼��1molˮ��Ӧ����һ����̼������������131.3kJ����
C��1mol��̬̼��1molˮ������Ӧ����1molһ����̼�����1mol������������131.3kJ
D��1����̬̼ԭ�Ӻ�1����ˮ������Ӧ����131.1kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ��Ϫ�и�һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
ֻ�������м��к����ж�Ӧ�������������һ�������ʵ����Ĺ�ʽ����
| �� | �� | �� | �� | �� |
�� | �������� | ���������Ħ����� | ������� | ��Һ���������� | �DZ�������ʵ����� |
�� | �����ӵ����� | ������������ | �����ܶ� | ��Һ����� | ���ʵ�Ħ������ |
A���ڢۢ� B���ۢܢ� C���ۢ� D���٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ϻ�����������У�߶���ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
���ںϽ���������ٺϽ������ٺ����ֽ������ںϽ��е�Ԫ���Ի��������ʽ���ڣ��ۺϽ���һ�����������ܺϽ�һ���ǻ���������ȷ����
A���٢ڢۢ� B���٢ۢ� C���ڢۢ� D���ۢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com