
【题目】某化合物的结构(键线式)及球棍模型以及该有机分子的核磁共振波谱图如下:
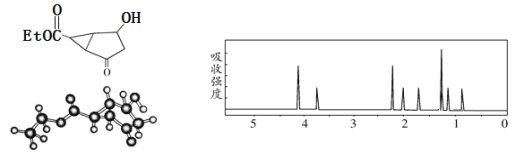
下列关于该有机物的叙述正确的是( )
A.键线式中的Et代表的基团为—CH2CH3
B.该有机物属于芳香族化合物
C.该有机物不同化学环境的氢原子有3种
D.1mol该有机物完全燃烧可以产生8molCO2和6molH2O
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】①将0.100 L 1.00 mol·L-1的纯碱溶液逐滴滴入0.100 L 1.25 mol·L-1的盐酸中;②将0.100 L 1.25 mol·L-1的盐酸逐滴滴入0.100 L 1.00 mol·L-1的纯碱溶液中;两种操作产生CO2的体积比为
A. 5∶2 B. 2∶5 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
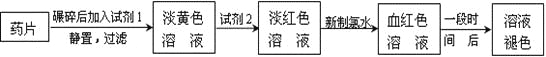
(1)试剂1是_______________________。
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是_______________________________________________________________。
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
编号 | 猜想 |
甲 | 溶液中的+3价Fe又被还原为+2价Fe |
乙 | 溶液中的SCN-被过量的氯水氧化 |
丙 | 新制的氯水具有漂白性,将该溶液漂白 |
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充)
编号 | 实验操作 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O和Na2O2组成的固体混合物溶于一定量的水中,充分反应后,收到标准状况下的气体1.12L,同时得到0.6molNaOH,求:
(1)原固体混合物中Na2O和Na2O2各是多少克?___、___
(2)所得溶液中应加入1mol/L的硫酸溶液多少毫升才能完全中和?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程(如图),乙醛在两电极分别转化为乙醇和乙酸。下列对电解过程的分析正确的是

A. 以铅蓄电池为电源,则a极为Pb电极
B. 石墨Ⅱ电极附近的pH逐渐减小
C. 阳极反应为CH3CHO+H2O-2e-=CH3COOH+2H+
D. 每处理含8.8g乙醛的废水,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如图所示。有关粒子浓度大小关系的比较正确的是( )
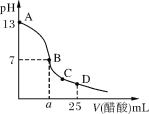
A.在A、B间任一点(不包含A、B两点),溶液中一定有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.在B点,a>12.5,且有:c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.稀硫酸和氢氧化钡溶液反应:SO42-+Ba2+ =BaSO4↓
B.金属钠与水反应:Na+2H+=Na++H2↑
C.大理石与盐酸反应:CaCO3+2H+ =H2O+CO2↑+ Ca2+
D.氯气通入冷水中:Cl2+ H2O=ClO-+Cl-+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石灰石一石膏法脱硫是除去工业烟气中所含SO2的重要方法,其工艺分为两步:一是吸收SO2产生亚硫酸氢钙,二是氧化产生石膏。某校化学兴趣小组实验模拟该工艺,设计置如下:
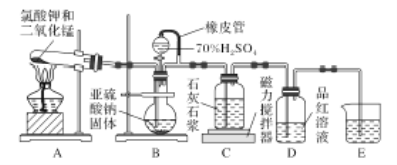
(1)装置B模拟产生含SO2的工业烟气,则E装置的作用是_______________。
(2)实验开始时,打开装置B中分液漏斗的活塞,向烧瓶中逐滴滴加硫酸,D中立即产生了明显的现象造成产生这一现象的原因是________。
A.该装置的气密性不够好
B.滴加硫酸的速率较快
C.使用的硫酸浓度较小
D.石灰石浆液中碳酸钙粉末的颗粒太小
(3)预计当装置C中________________的现象时,关闭装置B中分液漏斗的活塞,再点燃装置A处的酒精灯。实际实验过程中却始终未观察到C中产生这一现象,小组成员多次进行实验探究,最终发现是药品Na2SO3部分变质,请写出定性实验发现药品Na2SO3问题的有关操作及现象:取少量的亚硫酸钠固体于试管中,______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于合成氨N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-92.4 kJ·mol-1反应,达到平衡后,以下分析正确的是
2NH3(g)ΔH=-92.4 kJ·mol-1反应,达到平衡后,以下分析正确的是
A. 升高温度,对正反应的反应速率影响更大
B. 增大压强,对正反应的反应速率影响更大
C. 减小反应物浓度,对逆反应的反应速率影响更大
D. 加入催化剂,对逆反应的反应速率影响更大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com