[化学--物质结构与性质]
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
.在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为
正四面体
正四面体
.在四大晶体类型中,GaN属于
原子
原子
晶体.
(2)NH
3分子的空间构型是:
三角锥型
三角锥型
,中心原子N的杂化轨道类型是:
sp3
sp3
.
(3)NH
3与PH
3相比,热稳定性更强的是:
NH3
NH3
,理由是:
氮的原子半径比磷的原子半径小,N-H键长比P-H键长短,键能更大,分子更稳定
氮的原子半径比磷的原子半径小,N-H键长比P-H键长短,键能更大,分子更稳定
.
(4)一定压强,将NH
3和PH
3混合气体降温时,首先液化的物质是
NH3
NH3
,理由是:
因为氨分子之间存在氢键,使分子间作用力更大,沸点更高
因为氨分子之间存在氢键,使分子间作用力更大,沸点更高
.
(5)铜、铁元素能形成多种配合物.微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有
能够接受孤电子对的空轨道
能够接受孤电子对的空轨道
的原子或离子.

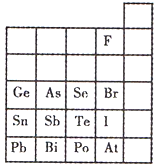 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.