
| A. | 粉末中一定有Na2O、Na202、NaHC03 | |
| B. | 粉末中一定不含有Na2C03和NaCl | |
| C. | 粉末中一定不含有Na20和NaCl | |
| D. | 无法肯定粉末里是否含有NaHCO3和NaC1 |
分析 盐酸可以和过氧化钠反应产生氧气,和碳酸钠、碳酸氢钠反应可以释放出二氧化碳,二氧化碳可以和氢氧化钠反应,氧气不反应,碳酸氢钠受热分解会生成二氧化碳气体,氧化钠和氧气反应是固体质量增加的反应.
解答 解:向混合物中加入足量的盐酸,有气体放出,与盐酸反应产生气体的物质可能为Na2O2(生成O2)、Na2CO3或NaHCO3(生成CO2),X通过NaOH溶液后体积缩小(而不是气体全部消失),说明X由O2和CO2组成,原粉末中Na2O2一定存在,Na2CO3和NaHCO3至少有一种一定存在.
将原混合粉末加热,有气体放出,说明混合物中一定有NaHCO3,但NaHCO3受热分解会使粉末质量减小,而实际剩余固体的质量却增加了,原因只能是发生了反应:2Na2O+O2=2Na2O2; 综上分析,混合物中一定有Na2O、Na2O2、NaHCO3,无法确定混合物中是否有Na2CO3和NaCl,即正确的是AD.
故选AD.
点评 本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及反应现象,本题注意氧化钠和过氧化钠的性质,难度中等.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | NaH与重水反应的方程式:NaH+D2O═NaOH+D2↑ | |
| B. | 三氟化氮的电子式: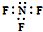 | |
| C. | 熔融状态下硫酸氢钠的电离方程式:NaHSO4(熔融)═Na++HSO4- | |
| D. | 硫化钠溶液显碱性的原因:S2-+H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W有4种不同结构(不考虑立体异构) | |
| B. | M分子中的3个C原子一定在同一平面上 | |
| C. | M、N、W均可发生氧化反应、还原反应和取代反应 | |
| D. | 若N中的O原子为18O,则上述反应充分进行后,所得混合物中N和W均含有18O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
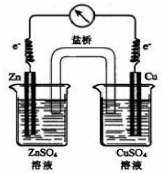
| A. | 该装置可以将化学能转变为电能 | B. | 电子由锌电极向铜电极移动 | ||
| C. | 盐桥中的阴离子向锌电极移动 | D. | 锌电极为正极,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 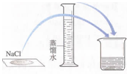 |  | 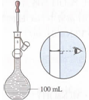 |
| A.接近称量质量时,轻振手腕,加够药品 | B.溶解时,用量筒控制所加蒸馏水的量 | C.移液时,玻璃棒插在刻度线以上,防止液体洒出 | D.接近刻度线1~2 cm时,用胶头滴管滴加蒸馏水至刻度线 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
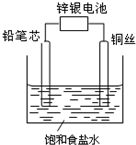 锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:
锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积等物质的量浓度的Na2CO3和Na2SO4溶液,Na2SO4溶液中的离子总数多于Na2CO3溶液 | |
| B. | 相同温度下,pH相等的NaHCO3溶液、NaClO溶液、NaOH溶液:c(NaClO)>c(NaHCO3)>c(NaOH) | |
| C. | 常温下,CH3COONa与HCl溶液混合所得中性溶液:c(Na+)=c(Cl-)>c(H+)=c(OH一) | |
| D. | 0.1 mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验组 | 温度℃ | 起始量mol | 平衡量mol | 达平衡所需时间min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com