
| A. | 等体积等物质的量浓度的Na2CO3和Na2SO4溶液,Na2SO4溶液中的离子总数多于Na2CO3溶液 | |
| B. | 相同温度下,pH相等的NaHCO3溶液、NaClO溶液、NaOH溶液:c(NaClO)>c(NaHCO3)>c(NaOH) | |
| C. | 常温下,CH3COONa与HCl溶液混合所得中性溶液:c(Na+)=c(Cl-)>c(H+)=c(OH一) | |
| D. | 0.1 mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
分析 A、根据n=cV可知,等体积、等物质的量浓度Na2SO4和Na2CO3溶液中含有的Na2SO4和Na2CO3的物质的量相等,根据碳酸根离子水解导致溶液阴离子总数增多进行解答;
B、酸根对应的酸越弱,水解程度越大,相等pH的溶液浓度越小,酸性H2CO3>HClO,所以pH相等的NaHCO3溶液、NaClO溶液、NaOH溶液,浓度大小为:c(NaHCO3)>c(NaClO)>c(NaOH);
C、CH3COONa与HCl混合溶液,根据电荷守恒c(Na+)+c(H+)=c(Cl-)+c(OH一)+c(CH3COO-),而溶液呈中性c(H+)=c(OH一),所以c(Na+)=c(Cl-)+c(CH3COO-);
D、根据混合溶液中的电荷守恒和物料守恒来分析.
解答 解:A、等体积等物质的量浓度的Na2CO3和Na2SO4溶液中,碳酸钠水解,CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,阴离子数增多,所以Na2SO4溶液中的离子总数小于Na2CO3溶液,故A错误;
B、酸根对应的酸越弱,水解程度越大,相等pH的溶液浓度越小,酸性H2CO3>HClO,所以pH相等的NaHCO3溶液、NaClO溶液、NaOH溶液,浓度大小为:c(NaHCO3)>c(NaClO)>c(NaOH),故B错误;
C、CH3COONa与HCl混合溶液,根据电荷守恒c(Na+)+c(H+)=c(Cl-)+c(OH一)+c(CH3COO-),而溶液呈中性c(H+)=c(OH一),所以c(Na+)=c(Cl-)+c(CH3COO-),故C错误;
D、根据混合溶液中的物料守恒可有:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)]①,根据物料守恒可有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)②,将①②两式联立可得:c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H2CO3),故D正确;
故选D.
点评 本题考查较为综合,涉及弱电解质的电离、盐类的水解以及离子浓度大小的比较,学生要注意物料和电荷守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
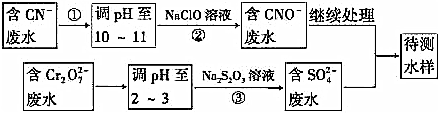
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 粉末中一定有Na2O、Na202、NaHC03 | |
| B. | 粉末中一定不含有Na2C03和NaCl | |
| C. | 粉末中一定不含有Na20和NaCl | |
| D. | 无法肯定粉末里是否含有NaHCO3和NaC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究温度对该反应速率的影响; c.实验①和④探究催化剂对该反应速率的影响. |
| ② | 298 | 0.5 | 0.0010 | |
| ③ | 323 | 0.5 | 0.010 | |
| ④ | 298 | 0 | 0.010 |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| ① | 14.0 | 13.0 | 11.0 |
| ② | 6.0 | 7.0 | 7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
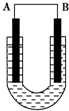 把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题:
把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和NaOH溶液 | B. | NH3和稀盐酸 | C. | NO2和水 | D. | SO2和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
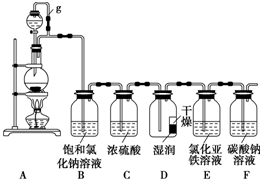
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
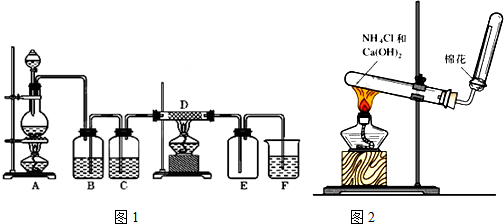
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com