
【题目】在2L恒容恒温密闭容器中,起始时按下表的量投入(容器中固体体积可忽略不计)物质,发生CaS(s)+ CO2(g)![]() CaCO3(s)+ H2S(g),该反应的平衡常数与温度的关系为lgK = (5003/T )—6.977。
CaCO3(s)+ H2S(g),该反应的平衡常数与温度的关系为lgK = (5003/T )—6.977。
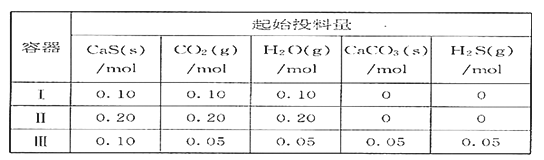
下列说法正确的是
A. 正反应为吸热反应
B. CO2 的平衡转化率:容器II = 容器III
C. H2S的平衡浓度:容器I = 容器III
D. 若容器I达平衡时,CO2的转化率为90%,则该温度下反应的平衡常数K=900
【答案】C
【解析】试题分析:因为该反应的平衡常数与温度的关系为lgK = (5003/T )—6.977,当温度升高后,K减小,所以该反应为放热反应。在2L恒容恒温密闭容器中,起始时按表中的量投入(容器中固体体积可忽略不计)物质,发生CaS(s)+ CO2(g)![]() CaCO3(s)+ H2S(g),由于该反应是一个气体分子数不变的反应,虽然水蒸气的投料不同,但是水蒸气不影响化学平衡,所以表中的3次不同的投料所达到平衡状态是等效的。A. 因为该反应的平衡常数与温度的关系为lgK = (5003/T )—6.977,当温度升高后,K减小,所以该反应为放热反应,A不正确;B. 容器II 和 容器III达到等效平衡,但容器III的起始投料有生成物,所以两容器中CO2 的平衡转化率不相同,B不正确;C. 容器I 和 容器III中投料除水蒸气不同外,其他投料是相当的,容器I 和 容器III达到等效平衡,容器I 和容器III 中H2S的平衡浓度相同,C正确;D. 若容器I达平衡时,CO2的转化率为90%,则CO2的变化量为0.10mol
CaCO3(s)+ H2S(g),由于该反应是一个气体分子数不变的反应,虽然水蒸气的投料不同,但是水蒸气不影响化学平衡,所以表中的3次不同的投料所达到平衡状态是等效的。A. 因为该反应的平衡常数与温度的关系为lgK = (5003/T )—6.977,当温度升高后,K减小,所以该反应为放热反应,A不正确;B. 容器II 和 容器III达到等效平衡,但容器III的起始投料有生成物,所以两容器中CO2 的平衡转化率不相同,B不正确;C. 容器I 和 容器III中投料除水蒸气不同外,其他投料是相当的,容器I 和 容器III达到等效平衡,容器I 和容器III 中H2S的平衡浓度相同,C正确;D. 若容器I达平衡时,CO2的转化率为90%,则CO2的变化量为0.10mol![]() ,CO2的平衡量是0.01mol,CO2的平衡浓度为0.005mol/L,H2S的平衡量为0.09mol,H2S的平衡浓度为0.045mol/L,则该温度下反应的平衡常数K=
,CO2的平衡量是0.01mol,CO2的平衡浓度为0.005mol/L,H2S的平衡量为0.09mol,H2S的平衡浓度为0.045mol/L,则该温度下反应的平衡常数K=![]() ,D不正确。本题选C。
,D不正确。本题选C。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】已知分解反应2N2O5(g)![]() 4NO2(g) + O2(g)的速率方程式v = k·cm(N2O5),k是与温度有关的常数,实验测定340K时的有关数据及根据相关数据做出的图像如下:
4NO2(g) + O2(g)的速率方程式v = k·cm(N2O5),k是与温度有关的常数,实验测定340K时的有关数据及根据相关数据做出的图像如下:
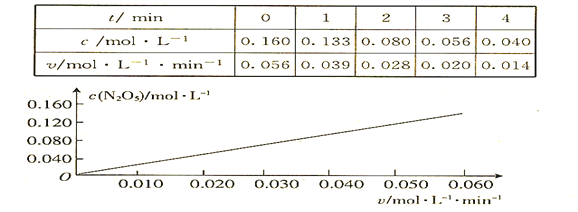
依据图表中的有关信息,判断下列有关叙述中不正确的是
A. 340K时,速率方程式中的m = 1
B. 340K时,速率方程式中的k = 0.350 min-1
C. 340K时,c(N2O5)= 0.100 mol·l-1时,v = 0.035 mol·l-1 ·min-1
D. 340K时,压强增大一倍,逆反应速率不变,正反应速率是原来的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝的叙述不正确的是
A. 铝是地壳中含量最多的元素
B. 在常温下,铝能与NaOH溶液反应
C. 铝是一种比较活泼的金属
D. 在化学反应中,铝容易失去电子,是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)芒硝的化学式是_________________。
(2)以氯化钠、石灰石、水为原料制取漂白粉,写出有关反应的化学方程式。
①______________________________;②_________________________________;
③______________________________;④_________________________________。
(3)元素铬(Cr)在溶液中主要以Cr3+、Cr2O72—(橙红色)、CrO42—(黄色)CrO2—等形式存在。回答下列问题:
①![]() 与
与![]() 的化学性质相似。写出向
的化学性质相似。写出向![]() 溶液中加入过量
溶液中加入过量![]() 溶液反应的离子方程式_____________________________________________。
溶液反应的离子方程式_____________________________________________。
②![]() 价铬的化合物毒性较大,常用
价铬的化合物毒性较大,常用![]() 将废液中的
将废液中的![]() 还原成
还原成![]() ,该反应的离子方程式为 ______________________________________________________。
,该反应的离子方程式为 ______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列制备金属单质的方法或原理正确的是
A.在高温条件下,用H2还原MgO制备单质Mg
B.在通电条件下,电解熔融Al2O3制备单质Al
C.在通电条件下,电解饱和食盐水制备单质Na
D.加强热,使CuO在高温条件下分解制备单质Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法. 已知:温度过高过氧化钙会分解生成氧化物和氧气.
【方法1】由Ca(OH)2为原料最终制得,其制备流程如下:
【方法2】由鸡蛋壳(含CaCO3高达90%)为原料最终反应制得,其制备流程如下:
(1)方法1中搅拌的目的是;请将搅拌过程中发生反应的化学方程式补充完整:CaCl2+H2O2+2NH3H2O+6═CaO28H2O↓+2NH4Cl;制备过程中除水外可循环使用的物质是(填化学式).
(2)方法2中气体X是 , 实验室常用溶液来检验;煅烧后的反应是化合反应,也能生成CaO28H2O,反应的化学方程式为;该反应需控制温度在0~2℃,可将反应器放置在中,获得CaO2产品中主要含有的固体杂质是(填化学式).
(3)这两种制法均要求在低温下进行(除煅烧外),温度过高除了防止氨水挥发外,还能
(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO28H2O的反应符合“绿色化学”的是(填“方法1”或“方法2”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com