
【题目】 a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为![]() 。下列比较中正确的是( )
。下列比较中正确的是( )
A. 原子半径:a>c>d>b B. 电负性a>b>d>c
C. 原子序数:d>a>c>b D. 最高价含氧酸的酸性c>d>a
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】已知常温时红磷比白磷稳定,在下列反应中:
4P(白磷,s)+5O2(g)====2P2O5(s);△H=== -a kJ/mol
4P(红磷,s)+5O2(g)====2P2O5(s);△H=== -b kJ/mol
若a、b均大于零,则a和b的关系为
A.a<bB.a=bC.a>bD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏伽德罗常数的值,下列说法正确的是
A. 2.8 g铁与0.05 mol Cl2充分反应,转移0.15NA电子
B. 27 g Al与足量NaOH溶液反应生成33.6 L H2
C. 14 g由乙烯(C2H4)和丙烯(C3H6)组成的混合物中含有原子的数目为3NA
D. 300 mL 0.2 mol/L蔗糖溶液中所含分子数为0.06NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界中不存在的P的一种同位素——![]() P,开创了人造核素的先河:
P,开创了人造核素的先河:![]() Al+
Al+![]() He→
He→![]() P+
P+![]() n。下列有关说法不正确的是( )
n。下列有关说法不正确的是( )
A. 该变化说明原子核在化学反应中也能发生变化
B. 该变化遵循质量守恒定律
C. ![]() n是一种电中性粒子
n是一种电中性粒子
D. 对于30P:原子序数=质子数=中子数=核外电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3: 物质结构与性质] 钾、碘、铁元素对人体的健康起到至关重要的作用,回答下列问题:
(1)基态K 原子核外有______种不同运动状态的电子,有_____种不同形状的电子云,价电子排布式是__________________。
(2)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于____晶体。
(3)赤铁盐(K3[Fe(CN)6])主要用于制药、电镀等工业,其煅烧分解生成KCN、(CN)2等物质。
①(CN)2中存在碳碳键,则分子中含有___个σ键,___个π键。
②KCN与盐酸作用产生HCN,则HCN中心原子C的杂化轨道类型__________________。
(4)KIO3晶体是一种性能良好的非线型光学材料,具有钙钛矿型的立体结构。
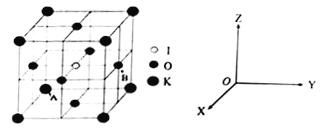
①已知A离子坐标参数为(0,0,0),则B离子的坐标参数________________。
②若KIO3晶胞参数为a纳米(nm)、阿伏伽德罗常数为NA,则该晶体密度为_____g·cm-3(列出计算式即可)。
③若碘原子处在各顶点位置,则钾离子和氧原子在晶胞中的位置分别是_______、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产、生活和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布图为______________。
(2)在氮分子中,氮原子之间存在着______个σ键和______个π键。
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3﹣,请写出两种与N3﹣互为等电子体的分子_______ 、_______。
(4)氮元素的氢化物(NH3)是一种易液化的气体,请阐述原因是_____________________。
(5)NF3、NCl3、NBr3的沸点由高到低的顺序是___________________________。
(6)Mg3N2遇水发生剧烈反应,生成一种有刺激性气味的气体.该反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化氮、二氧化氮等氮氧化物是常见的大气污染物,然而它们在工业上有着广泛的用途。
已知:①室温下,2NO+Na2O2===2NaNO2;
②酸性条件下,NO或NO2-都能与MnO反应生成NO3-和Mn2+,如5NO2-+2MnO4-+6H+===5NO3-+2Mn2++3H2O。
Ⅰ.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示:

(1)A中观察到的现象是_________________________________。
(2)B中反应的离子方程式是____________________,_______________________。
(3)装置C的作用是___________________,装置F的作用是__________________。
(4)若无装置D,则E中产物除亚硝酸钠外,还有副产物________(填化学式)。
Ⅱ.某研究性学习小组对NO2与Na2O2能否发生反应进行探究。
(提出假设)
假设一:NO2与Na2O2不反应;
假设二:NO2能被Na2O2氧化;
假设三:______________________________________________。
(设计实验)
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设________不成立。
(2)若假设二成立,则反应的化学方程式是_______________________。
(3)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成下表内容。
实验步骤(不要求写具体操作过程,试剂、仪器任选) | 预期的实验现象及结论 |
取适量的白色固体置于试管中,加蒸馏水溶解,_________________________ | _______________________________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com