
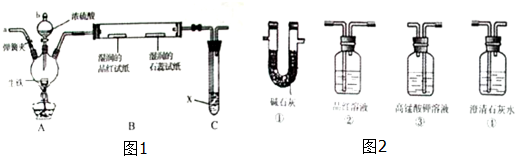
| ||
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H3=△H1+2△H2 |
| B、△H3=△H1+△H2 |
| C、△H3=△H1-2△H2 |
| D、△H3=△H1-△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、114.8 kJ |
| B、232 kJ |
| C、368.8 kJ |
| D、173.4 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
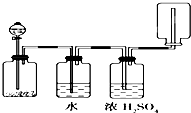
| A、KMnO4分解生成氧气 |
| B、二氧化锰和盐酸生产氯气 |
| C、碳酸钙和盐酸生成二氧化碳 |
| D、锌和盐酸生成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
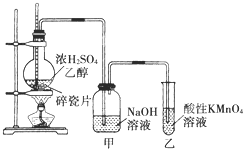 如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.
如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、给溶液加热,溶液的pH升高 |
| B、恒温下向溶液中加入CaO,溶液n(Ca2+)减少 |
| C、向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多 |
| D、向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com