
A是一取代芳香化合物,相对分子质量为136,分子中只含碳、氢、氧,其中氧的含量为23.5%。实验表明: A的芳环侧链上只含一个官能团;A和NaOH溶液反应后酸化可以得到E(C7H6O2)和F。
(1)A、E、F的结构简式。
(2)A和NaOH溶液反应、酸化的实验装置如下:
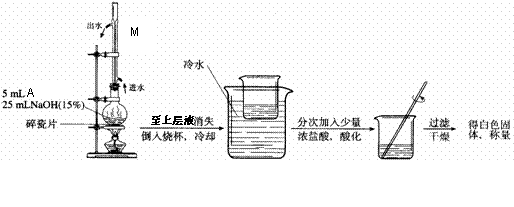 |
 写出A与NaOH溶液反应的化学反应方程式 。
写出A与NaOH溶液反应的化学反应方程式 。
写出实验装置中M的名称和作用 。
(3)A有多种同分异构体,符合下列条件的结构共有 种,
①可以发生银镜反应 ②属于芳香族化合物,不具备其它环状结构
③可以与氢氧化钠溶液反应 ④不能与FeCl3发生显色反应
请写出其中核磁共振氢谱有5个吸收峰的A的结构的结构简式:
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
在标准状况下,w L氮气含有x个N2分子,则阿伏加德罗常数可表示为 ( )
A.wx mol-1 B.22.4x mol-1 C.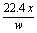 mol-1 D.
mol-1 D.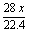 mol-1
mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是一种化学性质比较活泼的金属。也是用途最广泛的金属。铁在一定条件下能跟多种物质发生化学反应。完成下列问题:
(1)以铁为研究对象。仿照下图中的实例在框图处填写物质的化学式(所填写的反应物不属于同一类别的物质。生成物必须填写铁的化合物)。
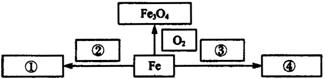
①________;②________;③________;④________。
(2)实验室要除去细碎铜屑中的少量铁屑,请用化学方法和物理方法将其除去。(只用简单的原理描述即可)
化学方法:________________。 物理方法:________________。
(3)据统计,每年锈蚀的钢铁约占世界钢铁年产总量的四分之一。联系生活、生产实际,举出防止钢铁生锈的两种常用方法:①________________;②________________。
(4)经研究发现。长期使用铁锅炒菜做饭,可有效地减少缺铁性贫血的发生,原因是________________;如果在炒菜时经常加入适量的食用醋,效果会更好,理由是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.铁管道与直流电源负极相连,防止铁管道腐蚀
B.小苏打、氢氧化铝可用于治疗胃酸过多
C.工业生产中,常将氯气通入澄清石灰水中,制取漂白粉
B.除去氯化钙溶液中少量盐酸,加入足量碳酸钙粉末,充分搅拌再过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
磷酸燃料电池是目前较为成熟的燃料电池,其基本组成和反应原理如下。
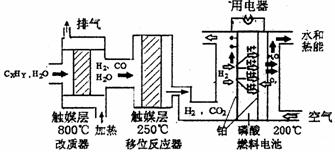
(1)在改质器中主要发生的反应为_______________________________
(2)移位反应器中CO(g)+H2O (g) 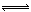 CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
| t/min | COmol/L) | H2O(mol/L) | CO2(mol/L) | H2(mol/L) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.1 |
| 3 | n1 | n2 | n3 | 0.1 |
| 4 | 0.09 | 0.19 | 0.11 | 0.11 |
①此温度下,该反应的平衡常数为________
②反应在3~4 min之间,氢气的物质的量增多的原因可能是 (填代号)
A.充入水蒸汽 B.升高温度 C.使用催化剂 D.充入氢气
(3)磷酸燃料电池负极排出的气体主要是___ __,
该电池正极的电极反应为_ _ __。
(4)磷酸燃料电池的电极上镀了铂粉,这样做的目的,除了起到更好的导电作用外,还具备的作用是 。
(5)总体看来,整个体系中能量来自与CxHy与空气的反应,假设CxHy为辛烷,且
已知辛烷的燃烧热为5 518 kJ·mol-1,请写出辛烷燃烧热的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中不能用化合反应的方法制得的是
①SiO2 ②H2SiO3 ③Fe(OH)3 ④Al(OH)3 ⑤FeCl2 ⑥ CaSiO3
A.①③ B.②④ C.②③④⑤ D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A.检验溶液中是否含有SO32-时,用HNO3酸化后再加BaCl2溶液
B.为提高KMnO4溶液的氧化能力,用盐酸酸化KMnO4溶液
C.检验某溶液是否含有Fe3+时,用HNO3酸化后,加KSCN溶液
D.检验溶液中是否含有SO42-时,用HCl酸化后,加BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO
等)生产Ni2O3。其工艺流程为:
 |
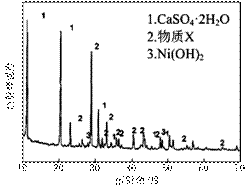
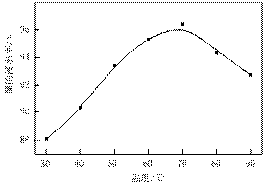
图Ⅰ 图Ⅱ
⑴根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为
。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
⑵工艺流程中“副产品”的化学式为 。
⑶已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。该实验方案合理吗?若合理,请说明理由;若不合理,请加以改正。__________________________________________。
⑷操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度
为 mol·L-1(常温时CaF2的溶度积常数为2.7×10-11)。抽滤装置中除了抽气泵、
安全瓶外,还需要的主要仪器有_____________________。
⑸电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液中加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则原溶液中( )。
A.一定溶有CO32- B.一定溶有Ag+
C.一定溶有SO42- D.可能溶有SO42-,也可能溶有Ag+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com