
| A、三氯化铁溶液中加入铁Fe3++Fe═2Fe2+ |
| B、氯化镁溶液中加入硝酸银溶液Ag++Cl-═AgCl↓ |
| C、过量氯气通入溴化亚铁溶液中2Fe2++2Br-+2Cl2═Fe3++Br2+4Cl- |
| D、硫化亚铁与盐酸反应 S2-+2H+═H2S↑ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、CuSO4溶液 |
| B、HBr溶液 |
| C、NaCl溶液 |
| D、硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2和K1的单位均为mol?L-1 |
| B、K2>K1 |
| C、c2(CO)=c2(H2O) |
| D、c1(CO)>c2(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
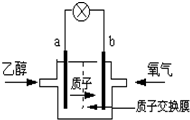
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,一定有Ag+ |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变红,一定有NH4+ |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,不一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | E | Y |
| Z | W |
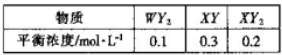
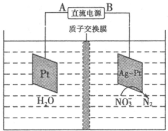
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100 mL 2 mol?L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B、用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C、对于C(s)+H2O(g)?CO(g)+H2(g)的反应,加入固体碳,反应速率加快 |
| D、往容器中再通入O2,可以加快反应2SO2+O2?2SO3的反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com