
2012��2��27���������ƽ��롰200��������ʱ����������β���ѳ�Ϊ��Ҫ�Ŀ�����Ⱦ�
��1��������ȼ������ʱ����Ӧ��N2(g)+O2(g) 2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��T��ʱ����2L�ܱ������г���4mol N2��6molO2��5min���ƽ��ʱNO���ʵ���Ϊ4mol���÷�Ӧ������v(N 2)Ϊ ������������µ�ƽ�ⳣ����д��������̣���
2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��T��ʱ����2L�ܱ������г���4mol N2��6molO2��5min���ƽ��ʱNO���ʵ���Ϊ4mol���÷�Ӧ������v(N 2)Ϊ ������������µ�ƽ�ⳣ����д��������̣���
��2�����º��ݣ���˵����Ӧ 2NO(g)  N2(g)+O2(g) �ﵽƽ����� ������ţ���
N2(g)+O2(g) �ﵽƽ����� ������ţ���
A��NO��N2��O2��Ũ��֮��Ϊ2��1��1
B��N2��Ũ�Ȳ��ٷ����仯
C����λʱ��������2 mol NO��ͬʱ����1 mol N2
D�������������ܶȲ��ٷ����仯
��3��H2��CO���Դ���ԭNO�Դﵽ������Ⱦ��Ŀ�ģ�
����֪��N2(g)+ O2(g) = 2NO(g) ��H = +180.5kJ/mol
H2(g)+1/2O2(g) = H2O(l) ��H = ��285.8kJ/mol
��H2(g)��NO(g)��Ӧ����N2(g)��H2O(l)���Ȼ�ѧ����ʽΪ ��
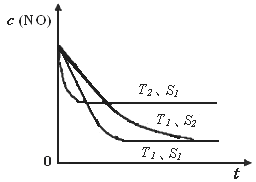
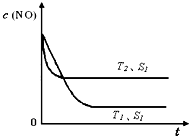
�ڵ�����һ��ʱ�������������ı���������ѧ��Ӧ���ʡ���ͼ�Ƿ�Ӧ��2NO(g) + 2CO(g)  2CO2(g)+ N2(g) ��NO��Ũ�����¶�(T)�����������(S)��ʱ��(t)�ı仯���ߣ��ݴ��жϸ÷�Ӧ�ġ�H
0 (�����������������ȷ����)���������ı����S1��S2
������ͼ�л���NO��Ũ����T1��S2 �����´ﵽƽ������еı仯���ߣ���ע��������
2CO2(g)+ N2(g) ��NO��Ũ�����¶�(T)�����������(S)��ʱ��(t)�ı仯���ߣ��ݴ��жϸ÷�Ӧ�ġ�H
0 (�����������������ȷ����)���������ı����S1��S2
������ͼ�л���NO��Ũ����T1��S2 �����´ﵽƽ������еı仯���ߣ���ע��������

��1��0.2mol/(L��min)
N2(g)+O2(g)  2NO(g)
2NO(g)
��ʼŨ��(mol��L-1) 2.0 3.0 0
ת��Ũ��(mol��L-1) 1.0 1.0 2.0
ƽ��Ũ��(mol��L-1) 1.0 2.0 2.0
ƽ�ⳣ��K=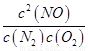 =
=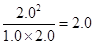
��2��BC
��3����2H2(g)+2NO(g)=N2(g)+2H2O(l) ��H=-752.1kJ/mol �ڣ�
��������
�����������1�����ݶ���ʽ��ֻ����ֱ�Ӽ���v(NO)=4mol��2L��5min=0.4mol/(L��min)���ٸ���ϵ���ȣ���Ӽ���v(N2)= v(NO)/2=0.2mol/(L��min)������ʼ���仯��ƽ��Ũ�ȹ�ϵ��֪��
N2(g)+O2(g) 2NO(g)
2NO(g)
��ʼŨ��/mol��L��1 2 3 0
�仯Ũ��/mol��L��1 1 1 2
ƽ��Ũ��/mol��L��1 1 2 2
K=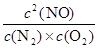 =
=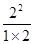 =2
=2
��2��A���˵���ﵽƽ�⣬��ΪNO��N2��O2�ı仯Ũ��֮��Ϊ2��1��1����ƽ��Ũ��֮�Ȳ�һ������ϵ��֮�ȣ�B����˵���ﵽƽ�⣬N2��Ũ�Ȳ��ٷ����仯��˵��N2���������ʵ����������ʣ����淴Ӧ���ʵ�������Ӧ���ʣ�C����˵���ﵽƽ�⣬��Ϊv(NO)����/v(N2)����=2/1�����v(NO)����/v(N2)����=2/1����v(N2)����= v(N2)������������Ӧ���ʵ����淴Ӧ���ʣ�D���˵���ﵽƽ�⣬����ֶ������壬���������������غ㣬�����ݻ����䣬�����Ƿ�ﵽƽ�⣬���������ܶ�һ�����䣻��3���ٵ�2���Ȼ�ѧ����ʽ��2����1���Ȼ�ѧ����ʽ����ԼȥO2(g)����2H2(g)+2NO(g)=2H2O(l)+N2(g) ��H=[(��285.8) ��2��(+180.5)]kJ/mol=��752.1kJ/mol���������¶�������Ӧ���ʣ����̴ﵽƽ���ʱ�䣬�ɴ��ƶ�ͼ���¶�T1<T2����ͼ��T1��T2ʱc(NO)������������ƽ�������ȷ����ƶ���c(NO)����˵��ƽ�����淴Ӧ�����ƶ������淴Ӧ�����ȷ�Ӧ����������Ӧ�Ƿ��ȷ�Ӧ������Ӧ�ġ�H <0���ۻ�ͼҪ�㣺a�������T1��S1ʱ��ͬ��b��ƽ���� T1��S1ʱ������ΪT1��S1��T1��S2���Ǽ�С�������������Ӧ���ʼ�С���ﵽƽ���ʱ������ c��ƽ��ʱc(NO)��T1��S1ʱ��ͬ����Ϊ��������ʹƽ���ƶ���
���㣺���йػ�ѧ��Ӧ���ʡ���ѧƽ�⡢�Ȼ�ѧ����ʽ�Ļ�ѧ��Ӧԭ���⣬����ƽ����Ӧ���ʵ�ֱ�Ӻͼ�Ӽ��㷽������ѧƽ�ⳣ���ļ�����̡���ѧƽ��״̬�ı�־����˹���ɵ�Ӧ�á�����Ũ��-ʱ��ͼ���ƶ��ʱ�������������ı�һ������ʱ��Ũ��-ʱ��ͼ��ȳ���������ʽ��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2012?��ɽ��ģ��2012��2��27���������ƽ��롰200��������ʱ����������β���ѳ�Ϊ��Ҫ�Ŀ�����Ⱦ�
��2012?��ɽ��ģ��2012��2��27���������ƽ��롰200��������ʱ����������β���ѳ�Ϊ��Ҫ�Ŀ�����Ⱦ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2.52 g�����谷����ԭ����ĿΪ0.12 NA | B����״����1 mol�������谷�����Ϊ22.4 L | C�������谷������ԼΪ10% | D�������谷��Ħ������Ϊ126 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���㶫ʡģ���� ���ͣ������
 2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��T ��ʱ����5L�ܱ������г���8mol N2��9molO2��5min���ƽ��ʱNO���ʵ���Ϊ6mol���÷�Ӧ������
2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��T ��ʱ����5L�ܱ������г���8mol N2��9molO2��5min���ƽ��ʱNO���ʵ���Ϊ6mol���÷�Ӧ������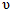 (NO)Ϊ________������������µ�ƽ�ⳣ����д��������̣���
(NO)Ϊ________������������µ�ƽ�ⳣ����д��������̣��� N2(g)+O2(g) �ﵽƽ�����__________������ţ���
N2(g)+O2(g) �ﵽƽ�����__________������ţ���  2CO2(g)+ N2(g) ��NO��Ũ�����¶�(T)�����������(S)��ʱ��(t)�ı仯���ߣ��ݴ��жϸ÷�Ӧ�ġ�H________0 (�����������������ȷ����)���������ı����S1��S2 ������ͼ�л���NO��Ũ����T1��S2 �����´ﵽƽ������еı仯���ߣ���ע��������
2CO2(g)+ N2(g) ��NO��Ũ�����¶�(T)�����������(S)��ʱ��(t)�ı仯���ߣ��ݴ��жϸ÷�Ӧ�ġ�H________0 (�����������������ȷ����)���������ı����S1��S2 ������ͼ�л���NO��Ũ����T1��S2 �����´ﵽƽ������еı仯���ߣ���ע�������� 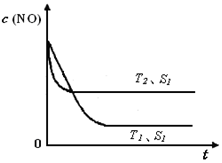
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ�ϲ��а�һ��ѧ���鶼��ѧ��������ѧ�߶����ϣ����л�ѧ�Ծ��������棩 ���ͣ������
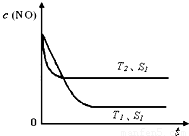
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com