
【题目】将a g聚苯乙烯树脂溶于bL苯中,然后通入c mol乙炔气体,所得混合液中碳氢两元素的质量比是( )
A. 6︰1B. 1︰2C. 8︰3D. 12︰1
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随pH的变化如图所示。下列叙述错误的是
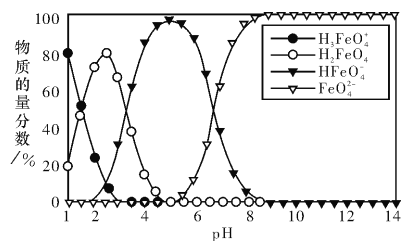
A. 已知H3FeO4+的电离半衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pII=4吋,溶液中![]()
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 向pH=5的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为HFeO4ˉ+OHˉ=FeO42-+H2O
D. pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)> c (HFeO4ˉ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G常用于有机合成和药物制造,一种合成G的路线如下,请回答相关问题。
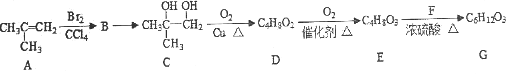
已知:①RCH2Br![]() RCH2OH;
RCH2OH;
②RCHO![]() RCOOH;
RCOOH;
③G分子中含有羟基。
(1)请用系统命名法给A命名_________________。
(2)A→B反应类型为__________。B→C反应试剂和反应条件是_______________。
(3)D分子中官能团名称为___________________。
(4)C→D反应的化学反应方程式为________________________________________。
(5)E→G反应的化学反应方程式为________________________________________。
(6)满足下列条件的E的同分异构体还有______种(不包括E),其中核磁共振氢谱中有四组峰,面积比为3:3:1:1的同分异构体的结构简式为_____________。
①与碳酸钠溶液反应有气体产生,②分子中无![]() 结构。
结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行相关实验。
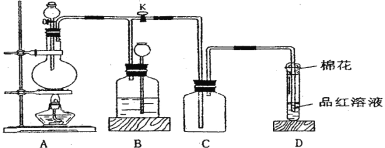
请回答:
⑴ 装置 A 中发生的化学反应方程式为_________。
⑵ 装置 D 中试管口放置的棉花中应浸一种液体,这种液体最好是下列哪种_________, 其作用是_________。
a.NaOH 溶液 b.NaCl 溶液 c.H2O d.NH4Cl 溶液
⑶ 装置 B 的作用是贮存多余的气体。当 D 处有明显的现象后,关闭旋塞 K 并移去酒精灯,但由于余热的作用,A 处仍有气体产生,此时 B 中现象是_________。B 中应放置的液体是(填字母)_________。
a.水 b.酸性 KMnO4 溶液 c.饱和 NaHSO3 溶液 d.浓溴水
⑷ 实验中,取一定质量的铜片和一定体积 18 mol·L—1 的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是______。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的物质是_________(填字母)。
a.BaCl2 溶液 b.锌粉 c.紫色石蕊试液 d.滴有酚酞的 NaOH 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s),
下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池工作时,电子由负极通过外电路流向正极
C. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
D. 外电路中每通过0.4mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用于研究有机物的方法错误的是( )
A.蒸馏常用于分离提纯液态有机混合物
B.燃烧法是研究确定有机物成分的有效方法
C.核磁共振氢谱通常用于分析有机物的相对分子质量
D.对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物有碳、氢、氧三种元素组成,其红外光谱图有C-H键、O-H键、C-O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式是( )
A. CH3CH2OCH3 B. CH3CH(OH)CH3
C. CH3CH2CH2OH D. CH3CH2CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,下列物质所占体积最大的是(NA表示阿伏加德罗常数)( )
A.18gH2OB.NA个氮气分子C.44.8L HCLD.含有5NA个氢原子的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:

完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式:
_____Cr2O72-+Fe3O4+H+→Cr3++Fe3++H2O
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应:阳极_____________________ 阴极_______________________;用铁做阳极的目的是:_____________________
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______________________
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是__________
(5)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为_____________________(保留四位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com