
(14分) 2SO2(g)+ O2 (g)  2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
温度/℃ | 400 | 500 | 600 |
SO2转化率/% | 99.2 | 93.5 | 73.7 |
(1)该反应是______反应(填“放热”或“吸热”)。
(2)400℃,1.01×105Pa时,将含10 mol SO2的原料气通入一密闭容器中进行反应,平衡时SO2的物质的量是______mol。
(3)硫酸厂尾气(主要成分SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若SO2与氨水恰好反应得到碱性的(NH4)2SO3溶液时,则有关该溶液的下列关系正确的是______(填序号)。
a. c + c(NH3?H2O)= 2[c()+ c()+ c(H2SO3)]
b. c()+ c(H+)= c()+ c()+ c(OH-)
c. c()> c() > c(OH-) > c(H+)
②用 MnO2与水的悬浊液吸收上述尾气并生产MnSO4。
i. 得到MnSO4的化学方程式是______。
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2吸收率与溶液pH的关系如图乙。


图甲中pH变化是因为吸收中有部分SO2转化为H2SO4,生成H2SO4反应的化学方程式是______;由图乙可知pH的降低______SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是______。
(14分)
(1)放热 0.08
(2)①ac
i. SO2+ H2O H2SO3 MnO2+ H2SO3===MnSO4+H2O(或MnO2+ SO2==MnSO4)
H2SO3 MnO2+ H2SO3===MnSO4+H2O(或MnO2+ SO2==MnSO4)
ii. 2SO2+ 2H2O +O2 === 2H2SO4
不利于 溶液中存在 SO2+ H2O  H2SO3
H2SO3 H++,当溶液中酸性增强,平衡向左移动,使SO2从体系中溢出。
H++,当溶液中酸性增强,平衡向左移动,使SO2从体系中溢出。
【解析】
试题分析:(1)温度升高二氧化硫的转化率降低,说明升高温度平衡逆向移动,所以正向为放热反应;
(2)该条件下二氧化硫的转化率为99.2%,所以10 mol SO2的原料气平衡时剩余10×(1-99.2%)=0.08mol SO2
(3)①根据物料守恒规律,c(NH4+)+c(NH3·H2O)=2c(H2SO3)+2c(SO32-)+ 2c(HSO3-),a正确;b不符合电荷守恒规律,错误;(NH4)2SO3溶液为碱性溶液,说明SO32-的水解程度大于NH4+的水解程度,所以溶液中离子浓度的大小关系是c(NH4+)>c(SO32-)>c(OH-)>c(H+),c正确;答案选ac;
②i.二氧化硫与水反应生成亚硫酸,亚硫酸与二氧化锰发生氧化还原反应生成硫酸锰,化学方程式为H2O+SO2 H2SO3 MnO2+ H2SO3= MnSO4+H2O;
H2SO3 MnO2+ H2SO3= MnSO4+H2O;
ii.SO2与水、氧气反应生成硫酸,化学方程式为2SO2+2H2O+ O2=2 H2SO4;由乙图可知,pH减小,二氧化硫的吸收率下降,所以pH的降低不利于SO2的吸收;因为二氧化硫溶于水后存在平衡H2O+SO2 H2SO3
H2SO3 H++ HSO3-,当溶液中酸性增强,平衡向左移动,使二氧化硫从体系中逸出。
H++ HSO3-,当溶液中酸性增强,平衡向左移动,使二氧化硫从体系中逸出。
考点:考查反应的能量变化,化学平衡的移动,溶液中离子浓度的大小比较,化学方程式的判断与书写


 考前必练系列答案
考前必练系列答案科目:高中化学 来源:2013-2014北京市大兴区高三统一练习理综化学试卷(解析版) 题型:选择题
常温下有A、B、C、D分别是CH3COONa、NH4Cl、Na2SO4和盐酸四种溶液中的一种,已知A、B溶液的pH相同,A、C溶液中水的电离程度相同,下列说法正确的是
A. B溶液的pH<7 ,D溶液的pH>7
B. B溶液中水的电离程度最大
C. C与D等体积混合后,溶液中c(OH-)=c(CH3COOH)+ c(H+)
D. A与B等体积混合后,溶液中c(NH4+)> c(Cl-)> c(H+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三第二学期综合练习二理综化学试卷(解析版) 题型:简答题
(14分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。

(1)B中反应的离子方程式是____。
(2)A中溶液变红的原因是____。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为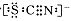
①甲同学认为SCN—中碳元素没有被氧化,理由是 。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是 。
③通过实验证明了SCN—中氮元素转化为NO3-,他的实验方案是____。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三二模理综化学试卷(解析版) 题型:选择题
下表中各组物质之间不能通过一步反应实现右图转化的是
| 甲 | 乙 | 丙 |
A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
B | SiO2 | H2SiO3 | Na2SiO3 |
C | Cl2 | HCl | CuCl2 |
D | AlCl3 | Al(OH)3 | Al2O3 |

查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古鄂尔多斯市高一下学期期末质量检测化学试卷(解析版) 题型:填空题
(12分)乙烯是石油裂解气的主要成分,其产量通常用来衡量一个国家石油化工发展水平。回答下列问题:
(1)乙烯的结构简式为 。
(2)下列能鉴别甲烷和乙烯的试剂是 。(填序号)
A.稀硫酸 B.溴的四氯化碳溶液
C.水 D.酸性高锰酸钾溶液
(3)若以乙烯为主要原料合成乙酸,其合成线路如下图所示

① B物质官能团的名称 。
② 反应Ⅱ的化学方程式为 ,反应类型是 。
③ 工业上以乙烯为原料可以合成一种重要的有机高分子化合物,该反应的化学
方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古鄂尔多斯市高一下学期期末质量检测化学试卷(解析版) 题型:选择题
为除去括号内的杂质,所选用的试剂或方法不正确的是
A.NaHCO3溶液(Na2CO3溶液) 通入过量的CO2
B.铁粉(铝粉) 加入适量的NaOH溶液过滤
C.Na2CO3溶液(Na2SO4溶液) 加入适量的Ba(OH)2溶液过滤
D.CO2 (CO) 将混合气体通过足量灼热的CuO
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:填空题
(12分)科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
2NH3(g)  H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。

①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的 ,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.改变反应的催化剂 D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(1)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H=+1530 kJ/mol
H=+1530 kJ/mol
又知:H2O(1)=H2O(g)  H=+44.0 kJ/mol
H=+44.0 kJ/mol
则2N2(g)+6H2O(g)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.该化合物仅含碳、氢两种元素 |
| B.该化合物中碳、氢原子个数比为1:4 |
| C.无法确定该化合物是否含有氧元素 |
| D.该化合物中一定含有氧元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com