
【题目】已知:6.4克铜与适量的浓硝酸反应,当铜完全溶解后,共收集到NO和NO2混合气体共2.24升(已折算为标准状况).求:
(1)被还原的HNO3的物质的量;
(2)混合气体中NOL,NO2L.
【答案】
(1)0.1mol
(2)1.12;1.12
【解析】解:(1)因HNO3中+5价的N被还原成NO中的+2价和NO2中的+4价,说明HNO3中的N得到了电子,Cu是被氧化的,失去了电子,这个过程中,得失电子守恒,即HNO3中N得到的电子=Cu失去的电子,产生的还原产物NO和NO2总共2.24L(标况),所以产生的NO和NO2总的物质的量是2.24/22.4=0.1mol,无论HNO3和Cu反应生成NO也好,NO2也好,总之,发生氧化还原反应的N元素是守恒的,HNO3→NO,HNO3→NO2 , 是一一对应的(只看N元素守恒),还原的HNO3的物质的量,就等于生成的NO和NO2的物质的量的和为0.1mol,所以答案是:0.1mol;(2)6.4gCu的物质的量为 ![]() =0.1mol,则转移电子为0.1mol×2=0.2mol,生成混合气体总物质的量为
=0.1mol,则转移电子为0.1mol×2=0.2mol,生成混合气体总物质的量为 ![]() =0.1mol,设NO2、NO的物质的量分别为xmol、ymol,则:x+y=0.1,x+3y=0.2,解得x=0.05,y=0.05,故NO2、NO的体积分别是:0.05mol×22.4L/mol=1.12L.所以答案是:1.12;1.12.
=0.1mol,设NO2、NO的物质的量分别为xmol、ymol,则:x+y=0.1,x+3y=0.2,解得x=0.05,y=0.05,故NO2、NO的体积分别是:0.05mol×22.4L/mol=1.12L.所以答案是:1.12;1.12.


科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( ) 
A.物质的量之比为3:2
B.质量之比为2:3
C.摩尔质量之比为2:3
D.反应速率之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于体积为1L的密闭容器中,发生如下反应:4A(g)+B(g) =2C(g) 反应进行到4s末,测得A为0.5 mol,B为0.4 mol, C为0.2mol。则用v(A)表示的该反应的速率为________,用v(B)表示的该反应的速率为________,用v(C)表示的该反应的速率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质依次按照混合物、氧化物、弱电解质和非电解质的顺序排列的一组是( )
A.淀粉、CuO、HClO、Cu
B.水玻璃、Na2O·CaO·6SiO2、Ag2O、SO3
C.KAl(SO4)2·12H2O、KClO3、NH3·H2O、CH3CH2OH
D.普通玻璃、H2O、HF、葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于FeCl3溶液和Fe(OH)3胶体描述正确的
A. FeCl3溶液能产生丁达尔现象,Fe(OH)3胶体不能产生丁达尔现象
B. FeCl3溶液不能产生丁达尔现象,Fe(OH)3胶体能产生丁达尔现象
C. 两者都能产生丁达尔现象
D. 两者都不能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,W,Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( ) 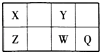
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应的反应过程中的能量变化如图所示,下列说法正确的是( )

A. 热化学方程式: H2+F2===2HF,ΔH = -270 kJ/mol
B. 氟化氢气体分解生成氢气和氟气的反应是放热反应
C. 在相同条件下,1 mol H2 (g) 与1 mol F2 (g) 的能量总和大于2 mol HF (g) 的能量
D. 其他条件不变,加入催化剂,该反应的ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2 mol/L的NaCl溶液980 mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是
A. 950 mL 111.2 g B. 500 mL 117.0g
C. 1000 mL 117.0 g D. 1000 mL 114.7 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素Q、R、X、Y、Z原子序数依次增大,Q元素的原子形成的离子就是一个质子;R基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,X基态原子s能级的总电子数比p 能级的总电子数多1;Y原子的核外成对电子数是未成对电子数的3倍;Z原子的价电子排布为3d74S2。回答下列问题:
(l)R、X、Y第一电离能由大到小的顺序是________(填元素符号),其中Y原子的价电子轨道表示式为______________________。
(2)Q、R元素形成的某四核分子中共有14个电子,该分子中R原子采取______ 杂化,该分子的立体构型为___________。
(3)X与Q形成的简单化合物的水溶液中存在多种氢键,任表示出其中两种_____________,_____________;
(4)RY可以和很多过渡金属形成配合物,如Fe(RY)5、Ni(RY)4,其中Fe(RY)5常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断Fe(RY)5晶体属
于______________(填晶体类型),与RY互为等电子体的离子有__________(任写一种)。
(5)向含Z2+的溶液中加入过量的氨水,并通入适量的Y2气休,生成有[Z(NH3)6]3+离子,则该反应的离子方程式为_____________________________。
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如右图所示。该合金的化学式为________________;
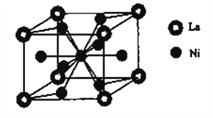
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com