
����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��Q��R��X��Y��Zԭ��������������QԪ�ص�ԭ���γɵ����Ӿ���һ�����ӣ�R��̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��X��̬ԭ��s�ܼ����ܵ�������p �ܼ����ܵ�������1��Yԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3����Zԭ�ӵļ۵����Ų�Ϊ3d74S2���ش��������⣺
��l��R��X��Y��һ�������ɴ�С��˳����________����Ԫ�ط��ţ�������Yԭ�ӵļ۵��ӹ����ʾʽΪ______________________��
��2��Q��RԪ���γɵ�ij�ĺ˷����й���14�����ӣ��÷�����Rԭ�Ӳ�ȡ______ �ӻ����÷��ӵ����幹��Ϊ___________��
��3��X��Q�γɵļ������ˮ��Һ�д��ڶ������,�α�ʾ����������_____________��_____________��
��4��RY���Ժͺܶ���ɽ����γ�������Fe��RY��5��Ni��RY��4������Fe��RY��5�����³�Һ̬���۵�Ϊ��20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ����ݴ��ж�Fe��RY��5������
��______________��������ͣ�����RY��Ϊ�ȵ������������__________����дһ�֣���
��5����Z2+����Һ�м�������İ�ˮ����ͨ��������Y2���ݣ�������[Z��NH3��6]3+���ӣ���÷�Ӧ�����ӷ���ʽΪ_____________________________��
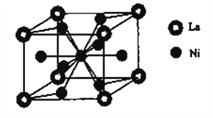
(6)����������(La)�γɵĺϽ���һ�����õĴ�����ϣ��侧���ṹʾ��ͼ����ͼ��ʾ���úϽ�Ļ�ѧʽΪ________________��
���𰸡� N>O>C ![]() sp ֱ���� N-H��N N-H��O ���Ӿ��� CN-��C22- 4Co2++24NH3��H2O+O2=4[Co(NH3)6]3++4OH-+22H2O LaNi5
sp ֱ���� N-H��N N-H��O ���Ӿ��� CN-��C22- 4Co2++24NH3��H2O+O2=4[Co(NH3)6]3++4OH-+22H2O LaNi5
�����������ڱ�ǰ�����ڵ�Ԫ��Q��R��X��Y��Zԭ��������������QԪ�ص�ԭ���γɵ����Ӿ���һ�����ӣ���QΪHԪ�أ�R��̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��ԭ�Ӻ���������Ų�ʽΪ1s22s22p2����RΪCԪ�أ�X��̬ԭ��s�ܼ����ܵ�������p�ܼ����ܵ�������1��ԭ�Ӻ���������Ų�ʽΪ1s22s22p3����XΪNԪ�أ�Yԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3����ԭ�Ӻ���������Ų�ʽΪ1s22s22p4����YΪOԪ�أ�Zԭ�ӵļ۵����Ų�Ϊ3d74s2����ZΪCo��
(1)ͬ������ԭ����������Ԫ�ص�һ�����ܳ��������ƣ�NԪ��ԭ��2p���Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ������ΪN��O��C��Yԭ�Ӻ���������Ų�ʽΪ1s22s22p4���۵��ӹ����ʾʽΪ![]() ���ʴ�Ϊ��N��O��C��
���ʴ�Ϊ��N��O��C��![]() ��
��
(2)H��CԪ���γɵ�ij�����й���14�����ӣ��÷���ΪC2H2��������Cԭ���ӻ������ĿΪ2��̼ԭ�Ӳ�ȡsp�ӻ����÷��ӵ����幹��Ϊֱ���Σ��ʴ�Ϊ��sp��ֱ���Σ�
(3)������ˮ��Һ�д��ڶ��������������N-H��N��N-H��O��O-H��O���ʴ�Ϊ��N-H��N��N-H��O��O-H��O(��д2��)��
(4)Fe(CO)5�����³�Һ̬���۵�Ϊ-20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ������Ϸ��Ӿ�����е����ʣ��ݴ˿��ж�Fe (CO)5�������ڷ��Ӿ��壬CO��N2��Ϊ�ȵ����壬��CO��Ϊ�ȵ������������ CN-�ȣ��ʴ�Ϊ�����Ӿ��壻CN-�ȣ�
(5)��Co2+����Һ�м�������İ�ˮ����ͨ��������O2���壬������[Co(NH3)6]3+���ӣ����ݵ���غ��֪��OH-���ɣ���÷�Ӧ�����ӷ���ʽΪ��4Co2++24NH3��H2O+O2=4[Co(NH3)6]3++4OH-+22H2O���ʴ�Ϊ��4Co2++24NH3��H2O+O2=4[Co(NH3)6]3++4OH-+22H2O��
(6)ÿ�������У�Laλ�ڶ��㣬8��![]() =1��Niλ�����ĺ����ģ�1+8��
=1��Niλ�����ĺ����ģ�1+8��![]() =5����ѧʽΪLaNi5���ʴ�Ϊ��LaNi5��
=5����ѧʽΪLaNi5���ʴ�Ϊ��LaNi5��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��6.4��ͭ��������Ũ���ᷴӦ����ͭ��ȫ�ܽ���ռ���NO��NO2������干2.24����������Ϊ��״��������
��1������ԭ��HNO3�����ʵ�����
��2�����������NOL��NO2L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��X��Y��Z��WΪ������Ԫ�أ�ԭ�Ӱ뾶X��99pm Y��154pm Z��125pm W��117pm��X��Y��Wλ����ͼ��ʾ������ʡ�ԣ���X��Y��Z������������Ӧ��ˮ������ܷ�Ӧ������˵����ȷ���ǣ� �� 
A.Ԫ��Z�������ڱ�����Ӱλ��
B.�ǽ����ԣ�X��W
C.X��W�γɻ������۵�ܸߣ�Ϊ���ӻ�����
D.Y��W������������Ӧ��ˮ�����ܷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��̲����ڵ��Ĺ̶����ǣ� ��
A.��ҵ�ϳɰ�
B.��ҵ���ð����������Ʊ�����
C.���絼�������к�������
D.����ֲ��ĸ��������캬��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ȶ����ͬ���칹����9�֣�����ȶ����ͬ���칹���У�������
A.7��B.8��C.9��D.10��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����Ҫ�Ľ�����
(1)����Ԫ�����ڱ��е�λ����_______________________________��
(2)�������������ȷ�Ӧ���Ӹֹ죬����������������Ӧ�Ļ�ѧ����ʽΪ____________�����ȷ�ӦҲ�������ڽ�����ұ������ͬѧ��Ϊ������þ�����ַ�һ���ڸ����¿�����þ��ұ��������Ϊ��˵��________����Իԣ�����Ϊ���Ե���˵��ԭ��____________________________��д��þ��ұ���Ļ�ѧ����ʽ ________________________________________����Ϊ�ԵĴ���ɲ�������
(3)����NaOH��Һ��Ӧ�����ӷ���ʽΪ_____________________��
(4)��AlCl3��ҺΪԭ����ȡ��ˮAlCl3�����Ƶ�AlCl3��6H2O���壬��Ҫ����������________������ȴ�ᾧ���۹��ˡ��ڵڢٲ�������Ӧע���������__________________��
(5).����AlCl3��6H2O���壬�ܽ�һ����ȡ��ˮAlCl3���˲���Ӧע����___________ ����ԭ����(��ϻ�ѧ����ʽ��Ҫ˵��)______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������N2��H2Ϊ��Ӧ�������A��ϡ����Ϊ�������Һ�����������ȼ�ϵ�أ�װ����ͼ��ʾ�������й�˵����ȷ����

A. ͨ��N2��һ��Ϊ����
B. ͨ��H2�ĵ缫��ӦΪ��H2+2e��=2H+
C. ����A��NH4Cl
D. ��Ӧ���������������ҺpH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�棨CH2=CHCN����һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ�������ϩ������������������Ҫ�������б�ϩȩ��CH2=CHCHO��������CH3CN �ȣ��ش��������⣺
��1���Ա�ϩ����������Ϊԭ�ϣ��ڴ������������ɱ�ϩ����C3H3N���������ϩȩ��CH2=CHCHO�����Ȼ�ѧ����ʽ���£�
�� C3H6(g)+NH3(g)��O2(g)=C3H3N(g)+3H2O(g����H=-515kJ/mol
�� C3H6(g)+O2(g)=C3H4O(g)��H2O(g) ��H=-353kJ/mol
��������߱�ϩ��ƽ����ʵķ�Ӧ������______����߱�ϩ�淴Ӧѡ���ԵĹؼ�������_____.
��2��ͼ��a��Ϊ��ϩ������뷴Ӧ�¶ȵĹ�ϵ���ߣ���߲��ʶ�Ӧ�¶�Ϊ460��������460��ʱ����ϩ��IJ���________��������������������������Ӧ�¶��µ�ƽ����ʣ��ж�������_____������460��ʱ����ϩ����ʽ��͵Ŀ���ԭ����________��˫ѡ�����ţ���
A���������Խ��� B.ƽ�ⳣ����� C������Ӧ���� D. ��Ӧ�������

��3����ϩ��ͱ�ϩȩ�IJ�����n������/n����ϩ���Ĺ�ϵ��ͼ��b����ʾ����ͼ��֪�����n������/n����ϩ��ԼΪ_________ ��������_______�����ϰ�����������ϩ���������ԼΪ____________��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com