
【题目】铝是一种重要的金属。
(1)铝在元素周期表中的位置是_______________________________。
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为____________。铝热反应也可以用于金属的冶炼,有同学认为将氧化镁和铝分放一起在高温下可用于镁的冶炼,你认为此说法________(填对或不对),认为不对的请说出原因____________________________并写出镁的冶炼的化学方程式 ________________________________________(认为对的此项可不作答)。
(3)铝与NaOH溶液反应的离子方程式为_____________________;
(4)以AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括①________,②冷却结晶,③过滤。在第①步操作中应注意的事项是__________________。
(5).加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,此操作应注意在___________ ,其原因是(结合化学方程式简要说明)______________。
【答案】 第3周期ⅢA族 2Al+Fe2O3![]() Al2O3+2Fe 不对 镁的活动性比铝的强 MgCl2(熔融)
Al2O3+2Fe 不对 镁的活动性比铝的强 MgCl2(熔融) ![]() Mg+Cl2↑ 2Al+2OH-+2H2O===2AlO+3H2↑ 加热浓缩 用玻璃棒不断搅拌溶液,当有晶体析出时停止加热 因存在AlCl3+3H2O
Mg+Cl2↑ 2Al+2OH-+2H2O===2AlO+3H2↑ 加热浓缩 用玻璃棒不断搅拌溶液,当有晶体析出时停止加热 因存在AlCl3+3H2O![]() Al(OH)3+3HCl,在干燥的HCl气流中,能抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,可得到纯净的AlCl3
Al(OH)3+3HCl,在干燥的HCl气流中,能抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,可得到纯净的AlCl3
【解析】本题主要考查铝及其化合物的性质。
(1)铝在元素周期表中的位置是第3周期ⅢA族。
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。铝热反应也可以用于金属的冶炼,有同学认为将氧化镁和铝分放一起在高温下可用于镁的冶炼,此说法不对,因为镁的活动性比铝的强。镁的冶炼的化学方程式为MgCl2(熔融)
Al2O3+2Fe。铝热反应也可以用于金属的冶炼,有同学认为将氧化镁和铝分放一起在高温下可用于镁的冶炼,此说法不对,因为镁的活动性比铝的强。镁的冶炼的化学方程式为MgCl2(熔融) ![]() Mg+Cl2↑。
Mg+Cl2↑。
(3)铝与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O===2AlO+3H2↑;
(4)以AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括①加热浓缩,②冷却结晶,③过滤。在第①步操作中应注意的事项是用玻璃棒不断搅拌溶液,当有晶体析出时停止加热,防止晶体受热分解。
(5).加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,此操作应注意在在干燥的HCl气流中进行,其原因是AlCl3+3H2O![]() Al(OH)3+3HCl,在干燥的HCl气流中,能抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,可得到纯净的AlCl3。
Al(OH)3+3HCl,在干燥的HCl气流中,能抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,可得到纯净的AlCl3。


科目:高中化学 来源: 题型:
【题目】已知某反应的反应过程中的能量变化如图所示,下列说法正确的是( )

A. 热化学方程式: H2+F2===2HF,ΔH = -270 kJ/mol
B. 氟化氢气体分解生成氢气和氟气的反应是放热反应
C. 在相同条件下,1 mol H2 (g) 与1 mol F2 (g) 的能量总和大于2 mol HF (g) 的能量
D. 其他条件不变,加入催化剂,该反应的ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,有以下三种:
部分氧化:CH4(g)+ ![]() O2(g)
O2(g)![]() CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH4 ④
2CO(g)+2H2(g) ΔH4 ④
则反应②自发进行的条件是________________,ΔH4 =_____________kJ·mol-1。
(2)起始向密闭容器中充入一定量的CH4(g)和O2(g),发生反应①。CH4(g)的平衡转化率与温度(T)和压强(P)的关系如图所示。
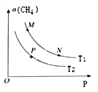
①N、P两点的平衡常数:K(N)_______K(P)(填“>”“<”或“=”),理由是_________。
②M、N两点的H2的物质的量浓度c(M)______c(N)(填“>”“<”或“=”)。
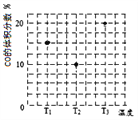
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g)![]() CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
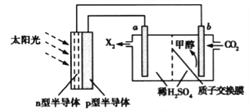
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等。则b极的电极反应式为___________________;当电路中有3mol电子转移时,质子交换膜两侧溶液相差_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素Q、R、X、Y、Z原子序数依次增大,Q元素的原子形成的离子就是一个质子;R基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,X基态原子s能级的总电子数比p 能级的总电子数多1;Y原子的核外成对电子数是未成对电子数的3倍;Z原子的价电子排布为3d74S2。回答下列问题:
(l)R、X、Y第一电离能由大到小的顺序是________(填元素符号),其中Y原子的价电子轨道表示式为______________________。
(2)Q、R元素形成的某四核分子中共有14个电子,该分子中R原子采取______ 杂化,该分子的立体构型为___________。
(3)X与Q形成的简单化合物的水溶液中存在多种氢键,任表示出其中两种_____________,_____________;
(4)RY可以和很多过渡金属形成配合物,如Fe(RY)5、Ni(RY)4,其中Fe(RY)5常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断Fe(RY)5晶体属
于______________(填晶体类型),与RY互为等电子体的离子有__________(任写一种)。
(5)向含Z2+的溶液中加入过量的氨水,并通入适量的Y2气休,生成有[Z(NH3)6]3+离子,则该反应的离子方程式为_____________________________。
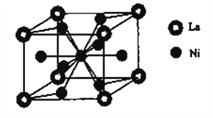
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如右图所示。该合金的化学式为________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
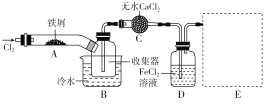
①检验装置的气密性; ②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成; ④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为____________________________________________。
(2)在③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是________。
(3)操作步骤中,为防止FeCl3潮解而采取的措施有(填步骤序号)________。
(4)装置B中冷水浴的作用为________;装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂____________。通常保存FeCl2溶液时要加入_______以防止被氧化,有关反应的离子方程式为________。
(5)在虚线框中画出尾气吸收装置E并注明试剂________。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量的说法正确的是( )
A. CO燃烧属于放热反应 B. H2SO4与NaOH反应属于吸热反应
C. 化学键断裂放出能量 D. 反应物总能量与生成物总能量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是( )
A. AlCl3和NaOH B. Fe和Cl2 C. Na和O2 D. Na2CO3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物在工业上有重要的应用.
(1)FeCl3净水的原理是(用离子方程式表示)_________________.FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)________________.
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2废液得到FeCl3.
①若酸性FeCl2废液中c(Fe2+)=2.0×10﹣2molL﹣1,c(Fe3+)=1.0×10﹣3molL﹣1,c(Cl﹣)=5.3×10﹣2molL﹣1,则该溶液的PH约为_____.
②完成NaClO3 氧化FeCl2 的离子方程式:
ClO3﹣ +___Fe2+ +___ ____= __Cl﹣ + ___Fe3++ __ ____.
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染.已知高铁酸盐热稳定性差,工业上用湿法制备K2FeO4的流程如图1所示:反应③加入浓KOH溶液可析出高铁酸钾(K2FeO4),这说明__________________________.某温度下,将Cl2通入NaOH溶液中,反应后得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO﹣与ClO3﹣离子的物质的量之比是1:2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为_____.
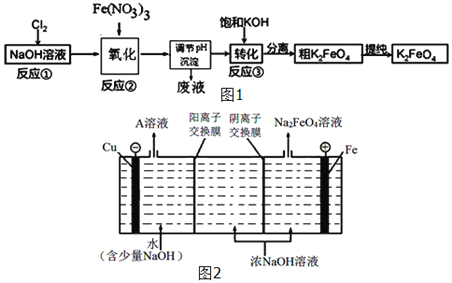
(4)工业上还可用通过电解浓NaOH溶液来制备Na2FeO4,其工作原理如图2所示:阳极的电极反应式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com