
| A、Al2O3 |
| B、MgO |
| C、SiO2 |
| D、P2O5 |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
| A、向NaOH溶液中逐滴滴入Fe2(SO4)3溶液直至过量 |
| B、将NaOH溶液逐滴滴入AlCl3溶液中,直至过量 |
| C、向AlCl3溶液中逐滴滴入稀硫酸 |
| D、将氨水逐滴滴入硝酸银溶液中,直至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.第二周期ⅤA族 |
| B、.第三周期ⅣA族 |
| C、.第二周期ⅥA族 |
| D、.第三周期Ⅶ族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
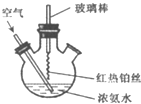
| A、反应后溶液中含有NO3- |
| B、反应后溶液中c(H+)增大 |
| C、实验过程中有化合反应发生 |
| D、实验过程中NH3?H2O的电离常数不可能发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、42He原子核内含有4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、42He的最外层电子数为2,所以42He具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
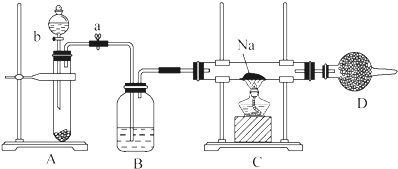
查看答案和解析>>
科目:高中化学 来源: 题型:
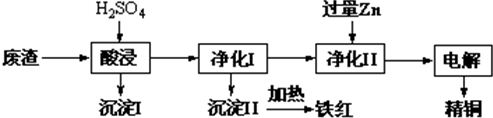
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、②③④ |
| C、②③⑥ | D、全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com