
【题目】下图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。请认真读图分析,回答有关问题。
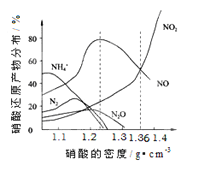
(1)下列叙述中正确的是(填序号)_______________。
A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越小。
B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已。
C.硝酸的浓度越大,还原产物中N元素低化合价产物越少
D.当硝酸密度大于1.3g·cm-3时,还原产物主要为NO、NO2
(2)从下图中选择仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(N2和O2的用量可自由控制,加热装置和固定装置省略)
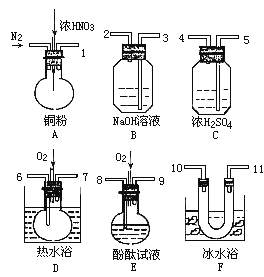
已知:Ⅰ.NO+NO2+2OH-=2NO2-+H2O
Ⅱ.常温下,NO2与N2O4混合存在,在0℃时几乎只有无色的N2O4液体或晶体存在。
①仪器的连接顺序(按左→右连接,填各接口的编号)为______________。
②反应前先通入N2,目的是___________________。
③确认气体中含的现象是__________________。
④装置F的作用是________________。
⑤若从A出来的混合气体中NO2、NO的体积分别为V1mL、V2mL(V1、V2均不为0),且本套装置最终能将氮的氧化物完全吸收,则装置中至少需要冲入氧气的体积为:________mL(相同状态下)。
【答案】 BCD 1→5→4→10→11→6→7→3→2(或1→5→4→11→10→6→7→3→2) 排除整个装置系统中的空气 D中气体变为红棕色 使NO2和NO分离 1/4V2mL
【解析】(1)本题考查影响氧化性强弱因素,A、图像所示的是硝酸密度与硝酸还原产物的分布,并不表示其浓度大小,故错误;B、根据图像的信息分析硝酸的浓度不同,其还原产物不相同,在某浓度时,会以某种产物为主,如硝酸浓度为1.36到1.4之间的点时,还原产物是NO2和NO,以NO2为主,故正确;C、根据图像,硝酸的浓度越大,硝酸还原产物中高价氮元素越来越多,低价态的越来越少,故正确;D、根据图像,当硝酸的密度大于1.3g/cm3时,还原产物主要是NO2、NO,其他还原产物几乎不存在,故正确;(2)本题考查实验设计方案的评价,①实验目的是验证铁与1.36g/cm3硝酸反应产物中含有NO,首先反应,制备气体,产生气体是NO2、NO、水蒸气,应除去水蒸气,用浓硫酸进行干燥,1→5→4,然后除去NO2,利用信息II,除去NO2,4→10→11或4→11→10,接着让NO转化成NO2,为防止生成NO2转化成N2O4,应在水浴中加热,即选择装置D进行NO的转化,即11→6→7,因为NO2和NO有毒,对环境有污染,必须除去,依据信息I,用NaOH除去NO和NO2,即7→3→2,综上所述,连接顺序是1→5→4→10→11→6→7→3→2;②因为NO与O2反应生成NO2,干扰实验,反应前通入N2的目的是排除装置的空气;③NO是无色气体,NO2是红棕色气体,因此装置D中气体变为红棕色,证明NO的存在;④装置F的目的是除去NO中混有NO2,或使NO2和NO分离;⑤根据信息I,完全被吸收,NO和NO2的体积比为1:1,设有xmL的NO转化成NO2,则NO2的体积为xmL,因此有(V2-x)=x,解得x=V1/2mL,依据2NO+O2=2NO2,需要通入氧气的体积为V2/4mL。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】羰基硫(O=C=S)广泛存在于以煤为原料制备的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染等。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=+7 kJ·mol-1
H2S(g)+CO(g) ΔH1=+7 kJ·mol-1
②水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35 kJ·mol-1
H2S(g)+CO2(g) ΔH2=-35 kJ·mol-1
请回答下列问题:
(1)已知热化学方程式:CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH3,则ΔH3 =_______。
H2(g)+CO2(g) ΔH3,则ΔH3 =_______。
(2)水解反应达到平衡后,若减小容器的体积,则逆反应速率_______________(填“增大”、“减小”或“不变”,下同),COS的转化率_______________。
(3)COS氢解反应的平衡常数K与温度T具有如下的关系式![]() (a、b均为常数)
(a、b均为常数)
①如图能表示COS的氢解反应的直线为____________。
②一定条件下,催化剂Ⅰ和Ⅱ对COS氢解反应的催化作用如下:
达到平衡所需时间/min | a 的数值 | b的数值 | |
催化剂Ⅰ | t | a1 | b1 |
催化剂Ⅱ | 2t | a2 | b2 |

则a1_______________a2 (填“>”、“<”、“=”)。
(4)某温度下,维持体系体积恒定,物质的量分别为m、n的COS蒸气和H2发生氢解反应。已知COS的平衡转化率为α,则在该温度下反应的平衡常数K=________(用m、n、α等符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
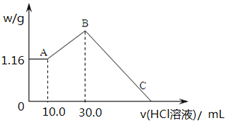
(1)A点的沉淀物的化学式为_________________。
(2)写出A点至B点发生反应的离子方程式:_____________________。
(3)某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为:______________,________________,________________。
(4)原混合物中NaOH的质量是________g,C点(此时沉淀恰好完全溶解)HCl溶液的体积为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据图1和图2所示,回答下列问题:

图1
(1)Y的化学式为__________________
(2)欲制备Na2S2O3,从氧化还原角度分析,合理的是______________(填序号)。
a.Na2S +S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
(3)将X与O2混合,可生成淡黄色固体。该反应的氧化剂与还原剂物质的量之比为_____________。
(4)图2为铜丝与W的浓溶液反应并验证其产物性质的实验装置。

图2
Ⅰ.①中反应的化学方程式是_____________。想要立即终止①的反应,最恰当的方法是__________。
a.上移铜丝,使其脱离溶液 b.撤去酒精灯 c.拔去橡胶塞倒出溶液
Ⅱ.④中棉花团的作用是_________________。
Ⅲ.反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B均为原子序数1﹣20的元素,已知A的原子序数为n,A2+离子比B2﹣离子少8个电子,则B的原子序数是( )
A.n+4
B.n+6
C.n+8
D.n+10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com