
【题目】下列各组微粒间不能形成配位键的是( )
A. Ag+和NH3 B. Ag+和H+ C. H2O和H+ D. Co3+和CO
科目:高中化学 来源: 题型:
【题目】下列物质按酸、碱、盐、有机物、混合物顺序排列的是( )
A. 硝酸、苛性钠、明矾、淀粉、氯水
B. 碳酸钠、盐酸、食盐、酒精、合金
C. 醋酸、纯碱、碳酸钙、硝基苯、石油
D. 氢溴酸、消石灰、高锰酸钾、福尔马林、石油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列晶体属于A1型最密堆积的是( )
A. 干冰、氯化钠、金属铜 B. 硫化锌、金属镁、氮化硼
C. 水晶、金刚石、晶体硅 D. 硫化锌、氯化钠、金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
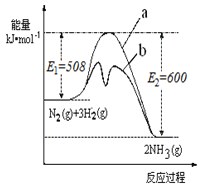
(1)根据如图提供的信息,写出该反应的热化学方程式 ,下图的曲线中 (填“a” 或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达
平衡的是 。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
ⅰ | 450 | 1/3 | 1 |
ⅱ | 1/3 | 10 | |
ⅲ | 480 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。请认真读图分析,回答有关问题。
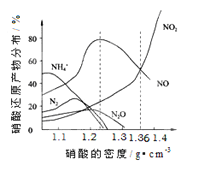
(1)下列叙述中正确的是(填序号)_______________。
A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越小。
B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已。
C.硝酸的浓度越大,还原产物中N元素低化合价产物越少
D.当硝酸密度大于1.3g·cm-3时,还原产物主要为NO、NO2
(2)从下图中选择仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(N2和O2的用量可自由控制,加热装置和固定装置省略)
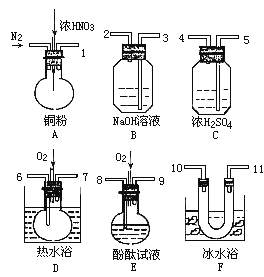
已知:Ⅰ.NO+NO2+2OH-=2NO2-+H2O
Ⅱ.常温下,NO2与N2O4混合存在,在0℃时几乎只有无色的N2O4液体或晶体存在。
①仪器的连接顺序(按左→右连接,填各接口的编号)为______________。
②反应前先通入N2,目的是___________________。
③确认气体中含的现象是__________________。
④装置F的作用是________________。
⑤若从A出来的混合气体中NO2、NO的体积分别为V1mL、V2mL(V1、V2均不为0),且本套装置最终能将氮的氧化物完全吸收,则装置中至少需要冲入氧气的体积为:________mL(相同状态下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)![]() NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢氨。
NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢氨。
(1)该反应在一定条件下能够白发进行,则反应的△H_____________0(填“>”、“<”或“一”)。
(2)写出生成碳酸氢氨的化学方程式:______________。
(3)实验步骤如下:
步骤1:按图所示组装仪器,检查装置的气密性。

步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品。
干燥管中盛放的药品是___________。
对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点是__________________。
③以恒压滴液漏斗代替分液漏斗的目的是______________________。
(4)该实验装置可能存在的安全问题是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三种主族元素在元素周期表中的位置如图所示。设X的原子序数为a,则下列说法不正确的是

A. Y的原子序数可能为a-17
B. Y与Z的原子序数之和可能为2a
C. Z的原子序数可能为a+31
D. X、Y、Z一定为短周期元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一。研究钢铁的腐蚀及防护有重要意义。回答下列问题:
(1)钢铁发生腐蚀的主要类型是电化学腐蚀,在电化学腐蚀中,负极反应是_____________,正极反应是_____________。
(2)某实验小组设计下列实验探究铁生锈的条件:
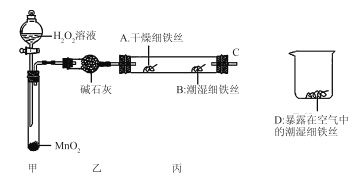
反应4 min后观察,发现A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮。该实验说明铁生锈主要与_________和___________有关;B、D处实验现象对比说明:决定铁生锈的一个重要因素是___________。
(3)金属及塑料制品表面镀铬不仅美观还可提高金属制品抗腐蚀性能。常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成。
①重铬酸中,Cr元素的化合价为________。
②镀铬时由CrO42-放电产生铬镀层。阴极的电极反应式为_______。
(4)电镀废水中Cr2O72-具有高毒性,必须经处理后才能排放。电解法处理含铬的强酸性废水的原理如右图所示。
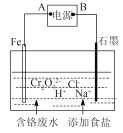
电解产生的Fe2+将Cr2O72-还原为Cr3+,再随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成。
①图中A为电源__________极;电解时阴极产生的气体为____________(写化学式)。
②写出Fe2+与Cr2O72-反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
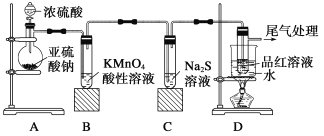
请回答:
(1)装置A中蒸馏烧瓶生成SO2的化学方程式为: 。
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为: 。
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象: 。
Ⅱ.某化学兴趣小组为探究铜跟浓硫酸的反应,用图所示装置进行有关实验。请回答:
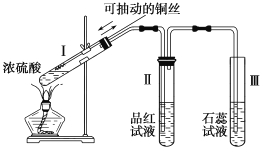
(4)试管Ⅰ中发生反应的化学方程式为:: 。
(5)下列实验不合理的是 。
A.上下移动Ⅰ中铜丝可控制生成SO2的量
B.Ⅱ中选用品红溶液验证SO2的生成
C.Ⅲ中可选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向Ⅰ加水,观察溶液颜色
(6)实验中,用ag铜片和VmL18.4mol·L-1的浓硫酸(98%)放在试管中共热,直到反应完毕,发现试管中还有铜片剩余,该小组学生认为还有一定量的硫酸剩余。
①有一定量的硫酸剩余但未能使铜片完全溶解,你认为原因是 。
②下列药品中能用来证明反应结束后的试管中确有硫酸剩余的是 (填序号)。
a.铁粉 b.BaCl2溶液 c.Ba(NO3)2溶液 d.Na2CO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com