
【题目】实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)![]() NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢氨。
NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢氨。
(1)该反应在一定条件下能够白发进行,则反应的△H_____________0(填“>”、“<”或“一”)。
(2)写出生成碳酸氢氨的化学方程式:______________。
(3)实验步骤如下:
步骤1:按图所示组装仪器,检查装置的气密性。

步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品。
干燥管中盛放的药品是___________。
对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点是__________________。
③以恒压滴液漏斗代替分液漏斗的目的是______________________。
(4)该实验装置可能存在的安全问题是__________________。
【答案】(1)<;(2)NH3+CO2+H2O=NH4HCO3;(3)①碱石灰;②无水无需干燥(或其他合理答案);③使氨水顺利滴下;(4)产品易堵导管;稀硫酸可能倒吸(或其他合理答案)(每空2分)
【解析】
试题分析:(1)根据方程式2NH3(g)+CO2(g) ![]() NH2COONH4(s)可知,该反应是熵值减小的可逆反应。如果该反应在一定条件下能够自发进行,则根据△G=△H-T·△S可知,该的焓变ΔH一定小于0。(2)有水参加,则生成碳酸氢铵,因此反应的化学方程式为NH3+CO2+H2O=NH4HCO3。(3)①由于制备氨基甲酸铵的原料氨气必须是干燥的,以防止副反应的发生,因此生成的氨气必须进行干燥。因为氨气是碱性气体,所以干燥氨气应该用固体氢氧化钠或碱石灰。②碳酸盐和酸反应制CO2,则生成的CO2必须进行净化和干燥处理,而直接利用干冰制备CO2,不需要干燥;又因为该反应是放热反应,提供低温环境,可以提高转化率。③恒压滴液漏斗代替分液漏斗可以平衡内外压强,使氨水顺利滴下。④反应后期随着CO2气流减慢,导致反应物比例不当,此时可以通过调节恒压滴液漏斗旋塞,减慢氨水滴加速度加以控制。(4)由于氨基甲酸铵是固体,所以产品易堵塞导管。又因为氨气极易溶于水,直接插入稀硫酸中吸收氨气,容易使稀硫酸倒吸。
NH2COONH4(s)可知,该反应是熵值减小的可逆反应。如果该反应在一定条件下能够自发进行,则根据△G=△H-T·△S可知,该的焓变ΔH一定小于0。(2)有水参加,则生成碳酸氢铵,因此反应的化学方程式为NH3+CO2+H2O=NH4HCO3。(3)①由于制备氨基甲酸铵的原料氨气必须是干燥的,以防止副反应的发生,因此生成的氨气必须进行干燥。因为氨气是碱性气体,所以干燥氨气应该用固体氢氧化钠或碱石灰。②碳酸盐和酸反应制CO2,则生成的CO2必须进行净化和干燥处理,而直接利用干冰制备CO2,不需要干燥;又因为该反应是放热反应,提供低温环境,可以提高转化率。③恒压滴液漏斗代替分液漏斗可以平衡内外压强,使氨水顺利滴下。④反应后期随着CO2气流减慢,导致反应物比例不当,此时可以通过调节恒压滴液漏斗旋塞,减慢氨水滴加速度加以控制。(4)由于氨基甲酸铵是固体,所以产品易堵塞导管。又因为氨气极易溶于水,直接插入稀硫酸中吸收氨气,容易使稀硫酸倒吸。


科目:高中化学 来源: 题型:
【题目】物质分类的依据通常有组成和性质,下列物质分类中,只考虑组成的是( )
A.Na2SO4是钠盐、硫酸盐、正盐
B.HNO3是一元酸、强酸、挥发性酸
C.Mg(OH) 2是二元碱、难溶性碱、中强碱
D.Al2O3是两性氧化物、金属氧化物、最高价氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气极其相关产品在生产生活中应用广泛。
(1)氯气属于有毒气体,贮氯罐意外泄漏时,消防员会喷洒稀氢氧化钠溶液,其作用是__________。(用化学方程式表示)。
实验室常用NaOH溶液吸收多余的氯气,下列也可用于吸收氯气的是_________(填字母)。
a.NaCl溶液 b.FeSO4溶液 c.KMnO4溶液
(2)家庭中常用消毒液(主要成分NaClO)、洁厕灵(主要成分盐酸)等清洁卫生。某品牌消毒液包装上的说明如下图。

①分析“对金属制品有腐蚀作用”的原因:_______________。
②需“密闭保存”的原因:______________。
③“与洁厕灵同时使用”会产生有毒的氯气,请写出反应的离子方程式_____________。
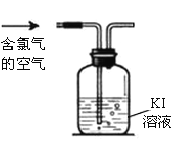
(3)已知空气中氯气含量超过0.1mg/m3就会引起中毒。某液氯生产车间在一次测定空气中氯气的含量时,测得消耗0.001ml/L Kl溶液100mL,为了判断空气中氯气的含量是否超标,还需要获得的数据是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,通电5 min时:第③极增重2.16 g,并且观察到A池中只有一个电极在产生气体,通电5min后 ,A池两极均有气体产生。设A池中原混合液的体积为200 mL,求
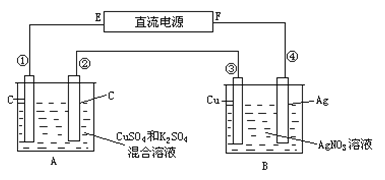
(1)直流电源E是________极;
(2)通电前A池中原混合溶液Cu2+的浓度____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废铅蓄电池量急速增加所引起的铅污染日益严重。工业上从废铅蓄电池的铅膏中回收铅的工艺流程如下:
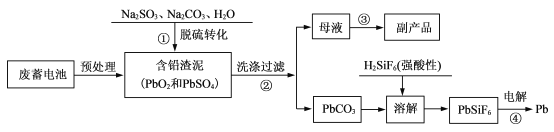
(1)铅蓄电池的总反应为Pb+ PbO2+2H2SO4 =2PbSO4+2H2O,该蓄电池放电时的负极反应式为__________,放电后该电极质量_______(填“增大”“减小”或“不变”)。
(2)步骤①中加入Na2SO3的作用是____________。
(3)写出步骤②证明PbCO3沉淀已经洗涤干净的实验操作方法:_______________。
(4)若用NH4HCO3和NH3·H2O为脱硫转化剂,也可对上述流程中的含铅渣泥进行处理。如图是NH4 HCO3和NH3.H2O用量对含铅渣泥中脱硫率的影响:
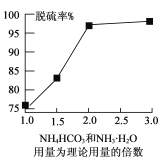
从图形可以看出,应选择NH4HCO3和NH3·H2O用量为理论用量的__________倍。该条件下步骤③从母液可获得副产品为_______________ 。
(5)步骤④使用纯铅和粗铅作电极,PbSiF6作电解质,可进行粗铅精炼。则阳极的电极材料是_________,阴极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既含有离子键又含有共价键的是( )
A. NaOH、H2O、NH4Cl B. KOH、Na2O2、(NH4)2S
C. H2O2 、MgO、Na2SO4 D. CaBr2 、HCl、 MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是
A. 漂白粉被氧化了
B. 有色布条被空气中的氧气氧化了
C. 漂白粉溶液跟空气中的CO2的反应充分,生成了较多量的次氯酸
D. 漂白粉溶液蒸发掉部分水,其浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀。根据上述实验事实,下列说法中,不正确的是
A.溶解度 MnS<PbS
B.MnS存在沉淀溶解平衡 MnS(s)![]() Mn2+(aq) + S2-(aq)
Mn2+(aq) + S2-(aq)
C.Cu2+转化为沉淀的原理为 MnS(s) + Cu2+(aq)=CuS(s) + Mn2+(aq)
D.沉淀转化能用于除去溶液中的某些杂质离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com