
【题目】Q、W、X、Y、Z是原子序数依次增大的短周期元素,Q和Y均满足主族序数与周期序数相等,Q与X、W与Z同主族,Q和W能形成原子个数之比为1:1和2:1的常见化合物。下列说法正确的是( )
A. 原子半径:Z>Y>X>W>Q
B. Q、X形成的化合物的电子式为![]()
C. 最简单氢化物的稳定性:Z>W
D. 工业上常用电解的方法制备X、Y的单质
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,可以制备一系列物质(见下图),下列说法正确的是( )

A. NH4Cl和NaHCO3都是常用的化肥
B. NH4Cl、HNO3和Na2CO3受热时都易分解
C. NH3和NO2在一定条件下可发生氧化还原反应
D. 图中所涉及的盐类物质均可与Ca(OH)2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢(PH3)是一种无色剧毒气体,沸点为-89.7℃,易自燃,与空气混合爆炸,微溶于水。其制取原理类似于实验室制氨气,现用下图装置来制取磷化氢并验证其性质。
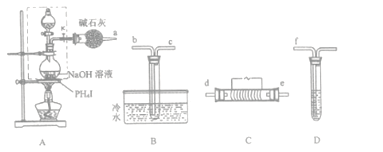
实验开始时,先从分液漏斗向盛有PH4I的圆底烧瓶中加入过量乙醚(无色液体,沸点34.5℃,微溶于水,不与Fe2(SO4)3反应),微热数分钟后再从分液漏斗向圆底烧瓶中加入一定量的浓NaOH溶液继续加热。在装置C处用电热器控制温度在300℃左右,实验过程中可观察到:B装置的试管中有白色蜡状固体生成;D装置的试管中Fe2(SO4)3溶液颜色由棕黄色变成淡绿色,同时也有白色蜡状固体生成。请回答:
(1)按气流方向连接装置,从左到右的顺序为:
a→______→ → → →f
(2)检查A中虚线框内装置的气密性的方法是____
(3)用PH4I和烧碱反应制取PH3的化学方程式是_____________。
(4)实验开始时,先向圆底烧瓶中加入乙醚并微热数分钟,其目的是__________。
(5)装置C中反应的化学方程式是____________;装置D中反应的离子方程式是_____________。
(6)装置B、D中的现象说明PH3具有的化学性质是_________(填字母序号)。
A.碱性 B.不稳定性 C.还原性 D.酸性
(7)实验时处理尾气的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己醇(![]() )常用来制取增塑剂和作为工业溶剂。下列说法正确的是( )
)常用来制取增塑剂和作为工业溶剂。下列说法正确的是( )
A. 环己醇中至少有12个原子共平面
B. 与环己醇互为同分异构体,且含有醛基(—CHO)的结构有8种(不含立体结构)
C. 标准状况下,1mol环己醇与足量Na反应生成22.4LH2
D. 环己醇的一氯代物有3种(不含立体结构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伞形酮可用作荧光指示剂和酸碱指示剂。其合成方法为
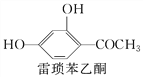

下列说法不正确的是( )
A. 雷琐苯乙酮、苹果酸和伞形酮各1 mol与足量Na反应生成H2体积之比为2∶3∶1
B. 雷琐苯乙酮和伞形酮都能跟FeCl3溶液发生显色反应
C. 1 mol雷琐苯乙酮跟足量H2反应,最多消耗4 mol H2
D. 1 mol伞形酮与足量NaOH溶液反应,最多消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃。某小组在实验室中拟用下图所示装置制取并收集C1O2。冋答下列问题:
(1)C1O2的制备
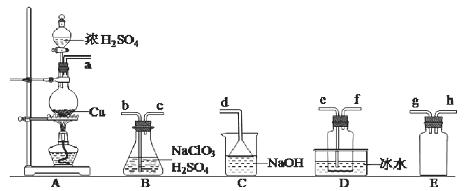
已知:SO2 +2NaClO3 +H2SO4 =2C1O2↑+2NaHSO4
①装置A中反应的化学方程式为_________________________。
②欲收集干燥的C1O2,选择上图中的装罝,其连接顺序为a→____________(按气流方向,用小写字母表示)。
③装置D的作用是_________________。
④若没有E装置,会造成的严重后果是____________________。
(2)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样;量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol/LNa2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)
①步骤2的反应中氧化产物的电子式为______。
②滴定终点的实验现象是_________________。
③原C1O2溶液的浓度为____g/L(用少骤中的字母代数式表示)。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_______;若滴定开始仰视读数,滴定终点时正确读数,则测定结果_____。(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com