
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
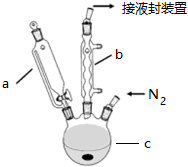
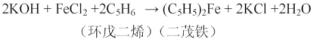
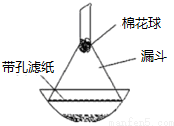
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化 学 键 | H-H | I-I |
| 断开1mol化学键时吸收的能量(kJ) | b | c |
| A. | 该反应中反应物的总能量高于生成物的总能量 | |
| B. | 断开1 mol H-H 键和1 mol I-I 键所需能量大于断开2 mol H-I 键所需能量 | |
| C. | 断开2 mol H-I键所需能量为(a+b+c)kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
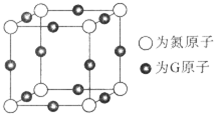 A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都 是2;B、C、D同周期;E核外的s、p能级的电子总数相;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答下列问题:(相关问题用元素符号表示)
A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都 是2;B、C、D同周期;E核外的s、p能级的电子总数相;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答下列问题:(相关问题用元素符号表示)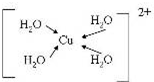 (配位键用→标出).
(配位键用→标出).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
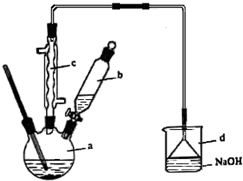 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 .该反应的类型是取代反应;装置d的作用是吸收HBr和Br2;
.该反应的类型是取代反应;装置d的作用是吸收HBr和Br2;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16mol | B. | 6mol | C. | 12mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ Na+ MnO4- SO42- | B. | Na+ CO32- Mg2+Cl- | ||
| C. | K+Na+ Cl-SO42- | D. | K+ Cl-Ba2+ HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com